
Isomerie
Wat is isomerie?
Isomerie is een chemisch fenomeen dat wordt gekenmerkt doordat moleculen met hetzelfde aantal atomen verschillende chemische of fysische eigenschappen hebben. Het komt dus voor in isomeren, die op hun beurt moleculen zijn waarvan de chemische formules dezelfde zijn, maar hun structuren of ruimtelijke ordening aanzienlijk van elkaar verschillen..
We hebben constitutionele of structurele isomerie en ruimtelijke isomerie, die veel aandacht besteedt aan stereochemie. Het stroomschema in de onderstaande afbeelding laat zien dat isomeren voornamelijk zijn onderverdeeld in de twee zojuist genoemde typen isomerie: constitutionele en stereo-isomeren..
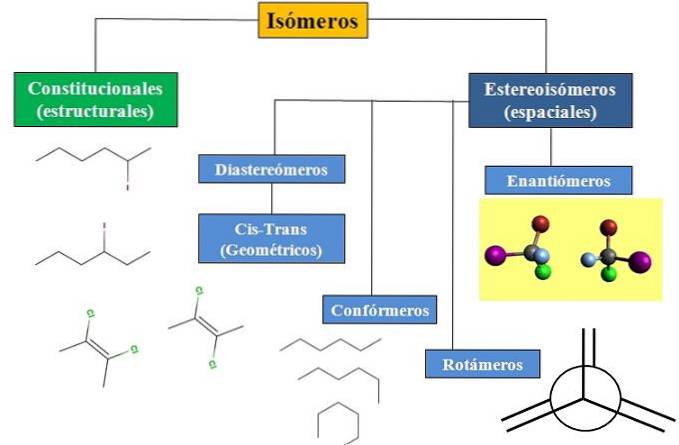
Alle isomeren hebben voor een bepaalde verbinding dezelfde chemische formule. Maar de structuren die deze atomen kunnen bouwen en hun verhoudingen zijn uniek voor elk molecuul of isomeer. Hoewel de structuur zelf hetzelfde is, kunnen de atomen of groepen verschillende ruimtelijke posities innemen..
Het stroomschema toont enkele voorbeelden van isomeren die in de volgende secties zullen worden besproken..
Soorten isomeren
Constitutioneel
Constitutionele of structurele isomeren zijn die welke verschillen in de volgorde van de moleculaire ruggengraat. Dat wil zeggen, hun atomen zijn niet op dezelfde manier met elkaar verbonden, dus de structuur of functionele groepen in kwestie kunnen heel verschillend worden..
Bijvoorbeeld voor dezelfde chemische formule C7H.10Of er kunnen meerdere moleculen zijn die aan dat aantal atomen voldoen; ze zullen allemaal een enkel zuurstofatoom hebben, maar de structurele rangschikking van de andere atomen zal uniek zijn voor elk isomeer.
En vandaar de chemische en fysische eigenschappen van alle constitutionele isomeren voor formule C.7H.10Of ze zullen ook sterk van elkaar verschillen.
Aan de andere kant kunnen constitutionele isomeren heel eenvoudig zijn en alleen variëren in de relatieve positie van een enkel atoom of groep. In de volgende sectie ziet u een voorbeeld hiervan en het bovenstaande.
Stereo-isomeren
Stereo-isomeren zijn die met dezelfde structurele ordening, maar verschillen in de posities en ruimtelijke oriëntaties van hun atomen of groepen..
Om te kunnen bestaan, moeten moleculen stereogene centra bevatten, waarvan de bekendste in de organische chemie asymmetrische of chirale koolstofatomen zijn; dat wil zeggen met vier verschillende substituenten.
Naast asymmetrische koolstofatomen moet het beschouwde molecuul elementen van symmetrie missen. Anders is het onmogelijk dat de ruimtelijke ordening stereo-isomerie wordt..
Enantiomeren
Enantiomeren zijn stereo-isomeren die bestaan uit niet-overlappende spiegelbeelden. Zo overlappen de rechter- en linkerhand elkaar niet, evenals schoenen of handschoenen. In de volgende sectie wordt het klassieke voorbeeld van enantiomerie besproken: broomchloor-domethaan: CBrClI.
Diastereomeren
Diastereomeren zijn daarentegen ook stereo-isomeren, maar het zijn geen spiegelbeelden. Dat wil zeggen, dat wat voor elkaar is geplaatst, is niet de weerspiegeling van zichzelf. Van de meest bekende diastereomeren hebben we de cis-trans-isomerie, ook wel geometrische isomerie genoemd, vooral wanneer toegepast op alkenen.
Conformers
Conformeren zijn, hoewel ze binnen het spectrum van stereo-isomerie vallen, eigenlijk geen isomeren. Het zijn ruimtelijke configuraties die een molecuul op een bepaald moment of in een bepaalde energietoestand verkrijgt door de rotaties van verschillende van zijn bindingen. We zullen in de volgende sectie het voorbeeld zien van de conformeren van de n-hexaan.
Rotameren
Ten slotte hebben we rotameren, die op conformeren lijken in de zin dat ze afhankelijk zijn van de rotatie van covalente bindingen..
Een enkele binding tussen twee koolstofatomen wordt echter als referentie genomen en de relatieve posities, of ze nu verduisterd of afwisselend zijn, van de substituenten voor beide koolstofatomen worden vergeleken. Later zullen we het voorbeeld van propyleenrotameren zien.
Voorbeelden van isomeren
Hexaan jodium
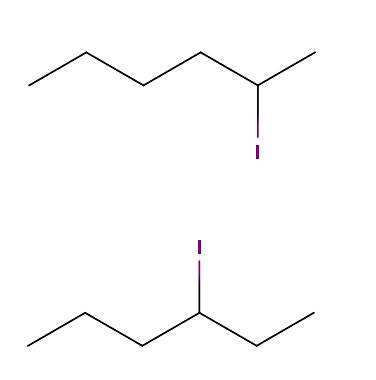
Hierboven hebben we twee moleculen waarvan de chemische formules C zijn6H.13I. In de eerste hebben we 2-joodhexaan, terwijl in de tweede 3-joodhexaan. Het zijn constitutionele isomeren van positioneel type, aangezien het skelet hetzelfde is, met het verschil dat de positie van het jodiumatoom van koolstof tot koolstof verschilt..
C3H.8OF
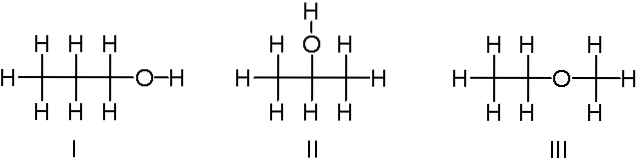
Hierboven hebben we nog een voorbeeld van constitutionele isomeren voor de chemische formule C3H.8O. Moleculen I en II zijn respectievelijk 1-propanol en 2-propanol. Het zijn beide alcoholen. In plaats daarvan gaat molecuul III over ethylmethylether.
Daarom spreken we van een andere functionele groep. Merk op dat de drie moleculen hetzelfde aantal atomen hebben, maar hun structuren zijn verschillend..
2,3-dichloor-2-buteen
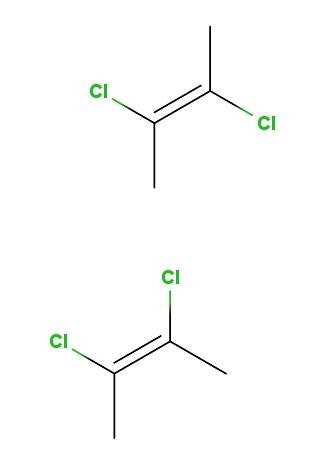
Hierboven hebben we het trans-2,3-dichloor-2-buteen-isomeer en hieronder het cis-2,3-dichloor-2-buteen-isomeer. In de eerste bevinden de chlooratomen zich in tegenovergestelde posities ten opzichte van de dubbele binding, terwijl ze in de tweede aan dezelfde kant van de dubbele binding liggen..
De ruggengraat van beide moleculen is hetzelfde, maar ze verschillen in de ruimtelijke posities van de chlooratomen; daarom zijn het stereo-isomeren, en aangezien het geen spiegelbeelden zijn, worden ze diastereomeren.
3-fluor-2-methylcyclohexaan
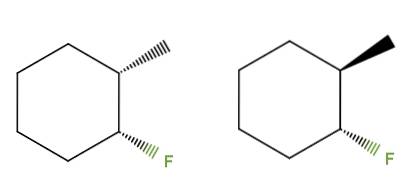
Deze keer hebben we in plaats van een dubbele binding een cyclohexaanring voor de verbinding 3-fluor-2-methylcyclohexaan. In de linker isomeer, de CH-groepen3 en F zijn onder het vlak van de ring; terwijl in de rechter, de CH3 is omhoog en de F is omlaag.
Daarom zou degene aan de linkerkant overeenkomen met het cis-isomeer, en degene aan de rechterkant zou het trans-isomeer zijn. Het zijn dus diastereomeren, want ook hier zijn het geen spiegelbeelden.
Conformers van n-hexaan
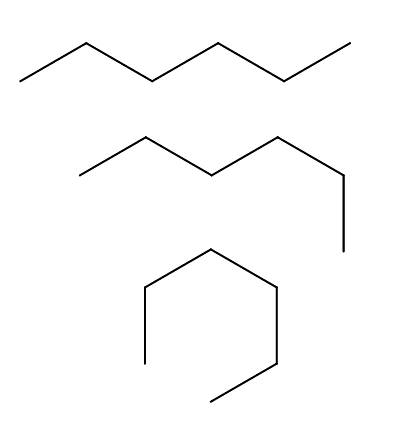
We hebben meer dan drie conformeren van de n-hexaan, die het resultaat zijn van de rotaties en "bochten" van de koolstofketen in verschillende oriëntaties. Ze komen allemaal overeen met hetzelfde molecuul van n-hexaan met verschillende vouwniveaus, die afhangen van de omgeving en de interne energie van elk molecuul.
3-broom-2-pentanol
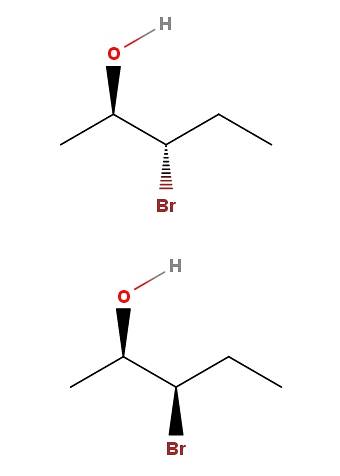
In 3-broom-2-pentanol hebben we nog een voorbeeld van een paar diastereomeren. Merk op dat nogmaals, in de isomeer hierboven OH en Br wijzen in de tegenovergestelde richting van het skeletvlak; terwijl in het lagere isomeer beide groepen in de richting van de lezer wijzen.
1-broom-3-chloor-5-ethylcyclohexaan
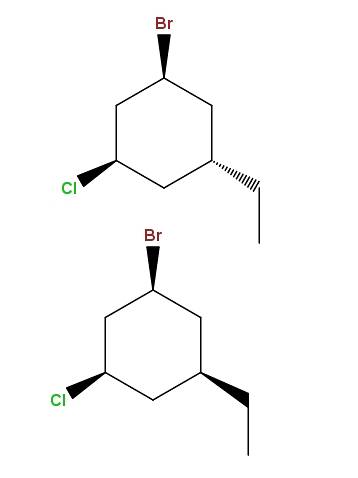
En nogmaals, we hebben weer een paar diastereomeren, met het verschil dat het verschil nu ligt in de ruimtelijke positie van een enkele groep: de ethyl, -CHtweeCH3.
Dit type isomeren heeft een heel specifieke naam: epimeren, diastereomeren waarvan de variatie alleen wordt waargenomen in de ruimtelijke configuratie van een enkele asymmetrische koolstof; in dit geval degene die gebonden is aan de -CHtweeCH3.
Bromochlooroyodomethaan
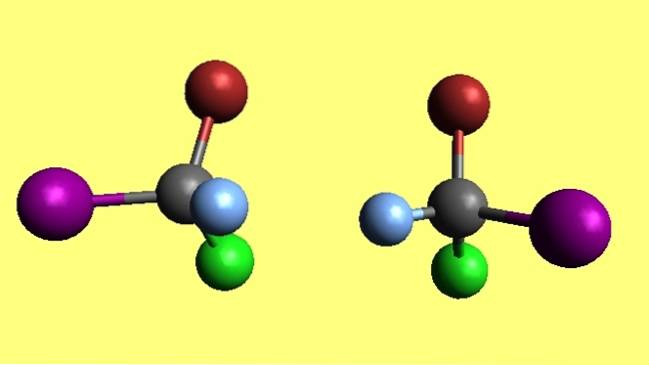
Merk op dat de twee broomchloorjoodmethaanmoleculen, CBrClI, enantiomeren zijn omdat de ene de niet-superponeerbare reflectie van de andere is. Hoe hard je ook je best doet, de vier atomen zullen nooit matchen. Ze zouden tegengestelde ruimtelijke configuraties bezitten.
2-broom-4-ethylcyclohexaan
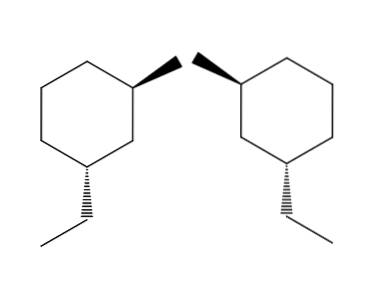
In het voorbeeld van het 2-broom-4-ethylcyclohexaan moleculenpaar is de enantiomerie zelfs nog duidelijker. Als we het molecuul aan de rechterkant proberen om te draaien, zien we dat de -CH-groeptweeCH3 het bevindt zich niet onder de ring maar erboven.
Evenzo is de CH3 Het wijst niet op de ring maar eronder. Ruimtelijke configuraties zijn omgekeerd, ze zijn tegengesteld. Dit is een van de belangrijkste kenmerken van enatiomerie..
Propyleen rotameren
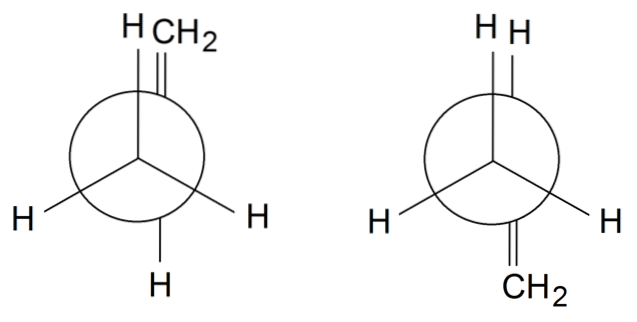
In propyleenrotameren roteren we om te eindigen de enkele binding tussen C1 en Ctwee: H3C-CH = CHtwee. De groep = CHtwee bevindt zich in een verduisterde positie met een van de H's van de CH-groep3 voorzijde op de rotameter aan de linkerkant. Ondertussen is de = CHtwee en H zijn in afwisselende posities op de rechter rotameer.
Afhankelijk van de verduistering of niet van de groepen, zullen we sterische hinder hebben, waardoor de rotameer zal destabiliseren. Daarom is de rotamer aan de rechterkant stabieler dan die aan de linkerkant..
Referenties
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. (10th editie.). Wiley plus.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley Iberoamericana.
- Dr. S. Gevorg. (2020). Enantiomeren, diastereomeren, identieke of constitutionele isomeren. Chemistry Stappen. Hersteld van: chemistrysteps.com
- Wikipedia. (2020). Isomeer. Hersteld van: en.wikipedia.org
- Allison Soult. (13 augustus 2020). Isomeren. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- James Ashenhurst. (2020). Stereochemie en chiraliteit. Hersteld van: masterorganicchemistry.com



Niemand heeft nog op dit artikel gereageerd.