
Isomerase-processen, functies, nomenclatuur en subklassen
De isomerasen Ze zijn een klasse van enzymen die betrokken zijn bij de structurele of positionele herschikking van isomeren en stereo-isomeren van verschillende moleculen. Ze zijn aanwezig in vrijwel alle cellulaire organismen die functies vervullen in verschillende contexten.
Enzymen van deze klasse werken op een enkel substraat, hoewel sommige covalent geassocieerd kunnen zijn met cofactoren, onder andere ionen. De algemene reactie kan daarom als volgt worden gezien:
X-Y → Y-X
De reacties die door deze enzymen worden gekatalyseerd, omvatten een interne herschikking van de bindingen, wat kan leiden tot veranderingen in de positie van functionele groepen, in de positie van dubbele bindingen tussen koolstofatomen, onder andere zonder veranderingen in de molecuulformule van het substraat..
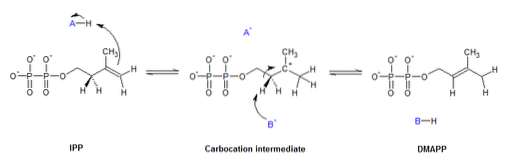
Isomerasen vervullen verschillende functies in een breed scala aan biologische processen, waaronder metabole routes, celdeling, DNA-replicatie, om er maar een paar te noemen..
Isomerasen waren de eerste enzymen die industrieel werden gebruikt voor de productie van siropen en ander suikerhoudend voedsel, dankzij hun vermogen om de isomeren van verschillende soorten koolhydraten onderling om te zetten..
Artikel index
- 1 Biologische processen waaraan ze deelnemen
- 2 functies
- 3 Nomenclatuur
- 4 subklassen
- 4.1 EC.5.1 Racemasen en epimerasen
- 4.2 EC.5.2 Cis-trans-isomerasen
- 4.3 EC.5.3 Intramoleculaire isomerasen
- 4.4 EC.5.4 Intramoleculaire transferasen (mutasen)
- 4.5 EC.5.5 Intramoleculaire lyases
- 4.6 EC.5.6 Isomerasen die de macromoleculaire conformatie veranderen
- 4.7 EC.5.99 Andere isomerasen
- 5 referenties
Biologische processen waaraan ze deelnemen
Isomerasen nemen deel aan meerdere vitale cellulaire processen. Een van de meest prominente zijn DNA-replicatie en verpakking, gekatalyseerd door topoisomerasen. Deze gebeurtenissen zijn cruciaal voor de replicatie van nucleïnezuur, evenals voor de condensatie ervan vóór celdeling..
Glycolyse, een van de centrale metabolische routes in de cel, omvat ten minste drie isomere enzymen, namelijk: fosfoglucose-isomerase, triosefosfaatisomerase en fosfoglyceraatmutase..
De omzetting van UDP-galactose in UDP-glucose in de galactosekatabolismeweg wordt bewerkstelligd door de werking van een epimerase. Bij mensen staat dit enzym bekend als UDP-glucose-4-epimerase..
Eiwitvouwing is een essentieel proces voor de functie van veel enzymen in de natuur. Het proteïne-disulfide-isomerase-enzym helpt bij de vouwing van proteïnen die disulfidebruggen bevatten door hun positie in de moleculen die het als substraat gebruikt te wijzigen..
Kenmerken
De belangrijkste functie van enzymen die tot de klasse van isomerasen behoren, kan worden gezien als het transformeren van een substraat door een kleine structurele verandering, om het vatbaar te maken voor verdere verwerking door enzymen stroomafwaarts in een metabole route, bijvoorbeeld.
Een voorbeeld van isomerisatie is de verandering van de fosfaatgroep op positie 3 naar de koolstof op positie 2 van het 3-fosfoglyceraat om het om te zetten in 2-fosfoglyceraat, gekatalyseerd door het enzym fosfoglyceraatmutase in de glycolytische route, waardoor een verbinding met hogere energie wordt gegenereerd wat is een functioneel substraat van enolase.
Nomenclatuur
De classificatie van isomerasen volgt de algemene regels voor de classificatie van enzymen die zijn voorgesteld door de Enzyme Commission (Enzyme Commission) in 1961, waarin elk enzym een numerieke code krijgt voor zijn classificatie.
De positie van de cijfers in deze code geeft elk van de divisies of categorieën in de classificatie aan en deze cijfers worden voorafgegaan door de letters "EC".
Voor isomerasen vertegenwoordigt het eerste getal de enzymatische klasse, het tweede geeft het type isomerisatie aan dat ze uitvoeren en het derde het substraat waarop ze inwerken..
De nomenclatuur van de isomeraseklasse is EC.5. Het heeft zeven subklassen, dus enzymen met de code van EC.5.1 tot EC.5.6 zullen worden gevonden. Er is een zesde "subklasse" van isomerasen die bekend staat als "andere isomerasen", waarvan de code EC.5.99 is, aangezien deze enzymen met verschillende isomerasefuncties omvat..
De aanduiding van de subklassen gebeurt voornamelijk volgens het type isomerisatie dat deze enzymen uitvoeren. Desondanks kunnen ze ook namen krijgen zoals racemases, epimerases, cis-trans-isomerasen, isomerasen, tautomerasen, mutasen of cyclo-isomerasen.
Subklassen
Er zijn 7 klassen enzymen binnen de isomerase-familie:
EC.5.1 Racemasen en epimerasen
Ze katalyseren de vorming van racemische mengsels op basis van de positie van de α-koolstof. Ze kunnen werken op aminozuren en derivaten (EC.5.1.1), op hydroxyzuurgroepen en derivaten (EC.5.1.2), op koolhydraten en derivaten (EC.5.1.3) en andere (EC.5.1.99).
EC.5.2 Cis-trans-Isomerasen
Katalyseer de omzetting tussen isomere vormen cis Y trans van verschillende moleculen.
EC.5.3 Intramoleculaire isomerasen
Deze enzymen zijn verantwoordelijk voor de isomerisatie van interne delen in hetzelfde molecuul. Er zijn er die redoxreacties uitvoeren, waarbij de elektronendonor en de acceptor hetzelfde molecuul zijn, dus ze worden niet geclassificeerd als oxidoreductasen.
Ze kunnen handelen door aldosen en ketosen om te zetten (EC.5.3.1), op keto- en enolgroepen (EC.5.3.2), door de positie van dubbele CC-bindingen (EC.5.3.3), van SS-disulfidebindingen te veranderen. (EC.5.3.4) en andere “oxidoreductases” (EC.5.3.99).
EC.5.4 Intramoleculaire transferasen (mutasen)
Deze enzymen katalyseren de positieveranderingen van verschillende groepen binnen hetzelfde molecuul. Ze zijn ingedeeld volgens het type groep dat ze 'verplaatsen'.
Er zijn de fosfomutasen (EC.5.4.1), diegene die aminogroepen overdragen (EC.5.4.2), diegene die hydroxylgroepen overdragen (EC.5.4.3) en diegene die andere soorten groepen overdragen (EC.5.4 99).
EC.5.5 Intramoleculaire lyasen
Ze katalyseren de "eliminatie" van een groep die deel uitmaakt van een molecuul, maar er nog steeds covalent aan is gebonden.
EC.5.6 Isomerasen die de macromoleculaire conformatie veranderen
Ze kunnen werken door de conformatie van polypeptiden (EC.5.6.1) of nucleïnezuren (EC.5.6.2) te veranderen.
EC.5.99 Andere isomerasen
Deze subklasse brengt enzymen samen zoals thiocyanaat-isomerase en 2-hydroxychroom-2-carboxylaat-isomerase..
Referenties
- Adams, E. (1972). Aminozuren, racemasen en epimerasen. De enzymen, 6, 479-507.
- Boyce, S., & College, T. (2005). Enzymclassificatie en nomenclatuur. Encyclopedia of Life Sciences, 1-11.
- Cai, C. Z., Han, L. Y., Ji, Z. L., & Chen, Y. Z. (2004). Enzymfamilieclassificatie door Support Vector Machines. Eiwitten: structuur, functie en bio-informatica, 55, 66-76.
- Dugave, C., en Demange, L. (2003). Cis - Trans-isomerisatie van organische moleculen en biomoleculen: implicaties en toepassingen. Chemische beoordelingen, 103, 2475-2532.
- Encyclopedia Britannica. (2018). Opgehaald op 3 maart 2019, van britannica.com
- Freedman, R. B., Hirst, T. R., & Tuite, M. F. (1994). Eiwitdisulfide-isomerase: bruggen bouwen bij het vouwen van eiwitten. TIBS, 19, 331-336.
- Murzin, A. (1996). Structurele classificatie van eiwitten: nieuwe superfamilies Alexey G Murzin. Structurele classificatie van eiwitten: nieuwe superfamilies, 6, 386-394.
- Nelson, D. L., en Cox, M. M. (2009). Lehninger-principes van biochemie. Omega-edities (5e ed.).
- Nomenclatuurcomité van de Internationale Unie voor Biochemie en Moleculaire Biologie (NC-IUBMB). (2019). Opgehaald van qmul.ac.uk
- Thoden, J. B., Frey, P. A., & Holden, H. M. (1996). Moleculaire structuur van het NADH / UDP-glucose-abortieve complex van UDP-galactose 4-epimerase van Escherichia coli: implicaties voor het katalytische mechanisme. Biochemie, 35, 5137-5144.



Niemand heeft nog op dit artikel gereageerd.