
Subatomaire deeltjes en hun kenmerken

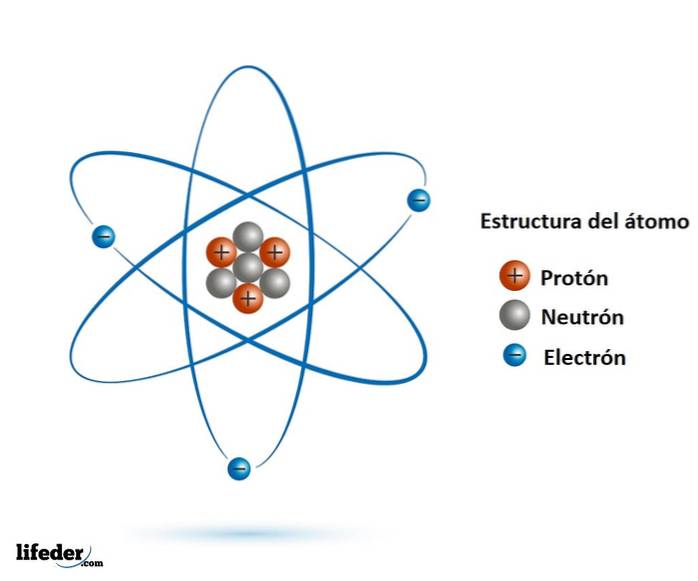
De subatomische deeltjes Ze zijn kleiner dan het atoom en worden in de natuur aangetroffen, bijna allemaal maken ze er deel van uit. We kennen de belangrijkste en meest stabiele, namelijk het elektron, het proton en het neutron..
Alle materie is samengesteld uit deze deeltjes, hoewel er andere zijn, hoewel hun bestaan lange tijd werd genegeerd. De eerste atoommodellen, daterend van enkele eeuwen voor Christus, gingen ervan uit dat de atomen ondeelbaar waren, zoiets als knikkers die, wanneer ze op een bepaalde manier gecombineerd werden, aanleiding gaven tot de verschillende elementen.
Toen bekend werd dat dit niet het geval was, dankzij de ontdekkingen van het elektron in de 19e eeuw en de atoomkern in het begin van de 20e eeuw, vroegen wetenschappers zich af of deze deeltjes een interne structuur hadden..
Het bleek dat ja, zowel het proton als het neutron zijn deeltjes die uit nog kleinere deeltjes bestaan, die geen interne structuur hebben: het zijn elementaire deeltjes.
Dat is de reden waarom subatomaire deeltjes zijn onderverdeeld in:
- Samengestelde deeltjes.
- Elementaire deeltjes.
De elementaire deeltjes zijn quarks, gluonen en leptonen. De quarks en gluonen vormen de protonen en neutronen, terwijl het elektron, een elementair deeltje, een lepton is.
Artikel index
- 1 Ontdekking van subatomaire deeltjes
- 1.1 De atoomkern: protonen en neutronen
- 2 De belangrijkste subatomaire deeltjes
- 2.1 Elektron
- 2.2 Proton
- 2.3 Neutron
- 2.4 Quarks
- 3 Andere deeltjes
- 4 referenties
Ontdekking van subatomaire deeltjes
De ontdekkingen van subatomaire deeltjes begonnen in de 19e eeuw en de eerste die werd gevonden was het elektron.
Rond 1890 waren natuurkundigen erg druk bezig met het bestuderen van straling en de transmissie van elektromagnetische golven. J. J. Thomson was een van hen en hij voerde talloze experimenten uit met een buis waarvan de lucht was verwijderd en waaraan een paar elektroden waren bevestigd..

Wanneer een spanning werd aangelegd, werden mysterieuze stralen geproduceerd, kathodestralen genaamd, waarvan de aard onbekend was, totdat J. J. Thomson (1856-1940) ontdekte dat ze uit een stroom negatief geladen deeltjes bestonden..
Thomson verkreeg het quotiënt tussen de lading en de massa van deze deeltjes: 1,76 x 108 C / g, waarbij C betekent coulomb, de eenheid voor elektrische lading in het internationale systeem van eenheden en g is gram.
En hij ontdekte twee heel belangrijke dingen, ten eerste dat de massa van de deeltjes extreem klein was, en ten tweede dat deze waarde voor alle deeltjes hetzelfde was, ongeacht waar de elektroden van gemaakt waren..
De waarde van de lading werd kort daarna, begin 1900, gevonden door de Amerikaanse natuurkundige Robert Millikan (1868-1953) en zijn medewerkers, dankzij het experiment van de druppel olie.
De atoomkern: protonen en neutronen
Aan het einde van de 19e eeuw had Henri Becquerel (1852-1908) het fenomeen natuurlijke radioactiviteit ontdekt, dat andere natuurkundigen zoals Marie en Pierre Curie en de Nieuw-Zeelander Ernest Rutherford intrigeerde..
De laatste vond drie verschillende soorten straling uit monsters van uranium, een bekend radioactief element. Hij noemde ze met de eerste drie letters van het Griekse alfabet: α, β en γ.
Rutherford-verstrooiingsexperimenten

Met behulp van de zeer energetische, positief geladen α-deeltjes bombardeerde Rutherford dunne goudfolies en ontdekte dat, zoals verwacht, de meeste α-deeltjes probleemloos door de folies gingen..
Maar merkwaardig genoeg werd een klein deel van de deeltjes afgebogen en enkele stuiterden zelfs in de tegenovergestelde richting. Dat laatste was onvoorstelbaar, want zoals Rutherford beweerde, was het alsof je met een geweer op een dunne zakdoek schoot en de kogels zag terugkomen..
De reden dat de α-deeltjes worden afgebogen, is dat er iets in de plaat zit dat ze afstoot en daarom positief moet worden geladen. Het is de atoomkern, klein van formaat, maar bevat bijna de hele massa van het atoom.
De ontdekking van het neutron

Het neutron duurde iets langer om gevonden te worden en was te danken aan de Engelse natuurkundige James Chadwick (1891-1974), een student aan Rutherford. Rutherford had zelf het bestaan van een ongeladen deeltje in de kern voorgesteld, om uit te leggen waarom het niet uiteenvalt als gevolg van elektrostatische afstoting.
Chadwick's experimenten onthulden in 1932 het bestaan van een deeltje met een massa dat sterk leek op dat van het proton, maar zonder lading. Daarom noemden ze het een neutron en samen met het proton zijn ze de essentiële componenten van de atoomkern.
De belangrijkste subatomaire deeltjes
Over het algemeen worden subatomaire deeltjes gekenmerkt door:
- Massa.
- Elektrische lading.
- Draai.
Spin is een kwaliteit analoog aan rotatie om de as, maar volledig kwantum van aard. En aan de andere kant zijn er deeltjes met lading en massa 0, zoals het foton.
Electron
Het elektron is een stabiel subatomair deeltje, negatief geladen en behorend tot de groep leptonen, zijnde degene met de laagste massa. Het is een essentieel onderdeel van het atoom, maar het kan er geïsoleerd van bestaan, in de vorm van vrije elektronen.
In feite is het de kleinste elektrische lading die in de natuur kan worden gevonden, dus elke andere lading is een veelvoud van die van het elektron, volgens het principe van ladingskwantisering..
De belangrijkste kenmerken zijn:
- Gewicht: 9,1 x 10-31 kg
- Belasting: e = -1,6 x 10-19 C
- Centrifugeren: ± ½
- Antiparticle: positron.
Het elektron is verantwoordelijk voor de vorming van chemische bindingen, evenals elektrische en thermische geleiding. En dankzij de kwantummechanica weten we dat het elektron een tweeledig gedrag heeft: golf en deeltje tegelijk.
Proton
Het is een elektrisch geladen deeltje, waarvan de lading even groot is als die van het elektron, maar met het tegenovergestelde teken..
Het proton is geen elementair deeltje zoals het elektron, maar is samengesteld uit drie quarks die zijn verbonden door gluonen en het is veel massiever dan het elektron.
In tegenstelling hiermee is het proton beperkt tot de atoomkern, en de hoeveelheid ervan bepaalt welk element het is, evenals de eigenschappen ervan..
- Gewicht: 1.672 x 10-27 kg
- Opladen: e = +1,6 x 10-19 C
- Centrifugeren: ½
- Antiparticle: antiproton.
Neutron
Het neutron vormt samen met het proton de atoomkern en het is ook samengesteld uit drie quarks: twee van het type naar beneden en enig in zijn soort omhoog.
- Gewicht: 1675 x 10-27 kg
- Geen nettokosten.
- Centrifugeren: ½.
Het is een stabiel deeltje in de atoomkern, maar vervalt als vrij deeltje met een halfwaardetijd van ongeveer 10,3 minuten. Zijn massa is iets groter dan die van het proton en zoals we al zeiden, heeft het geen nettolading..
Het aantal neutronen in een atoom is belangrijk, want hoewel het de aard van het element niet bepaalt, zoals het proton, bepaalt het wel de klasse van isotoop..
De isotopen van een element zijn varianten ervan en hun gedrag kan behoorlijk van elkaar verschillen. Er zijn stabiele en onstabiele, waterstof heeft bijvoorbeeld deuterium en tritium als isotopen.
Door de atomen van bepaalde uranium- en plutoniumverbindingen te beschieten met neutronen, splijt de kern en valt uiteen in deeltjes. De nucleaire kettingreactie die optreedt, kan een grote hoeveelheid energie afgeven.
Quarks
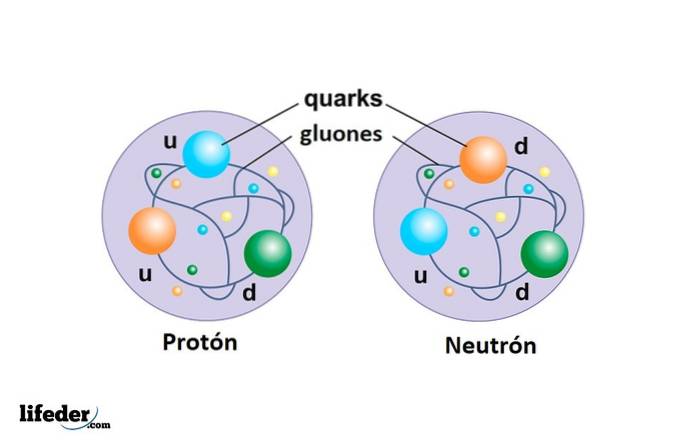
Ze zijn de bestanddelen van protonen en neutronen. Tot dusver zijn er 6 soorten quarks gevonden, maar geen als vrij deeltje, maar eerder geassocieerd om andere samengestelde deeltjes te vormen.
Het bewijs van zijn bestaan werd verkregen door experimenten die sinds de jaren zestig zijn uitgevoerd, met de Stanford lineaire versneller en later bij CERN.
- Opladen: + 2 / 3e, -1 / 3e
- Centrifugeren: ½
- Antiparticle: antiquark.
Andere deeltjes
Vanaf 1930 volgden de ontdekkingen van nieuwe deeltjes, waarvan vele theoretisch voorspeld werden. Het standaardmodel van deeltjes beschouwt het bestaan van 17 soorten fundamentele deeltjes, waaronder quarks, leptonen, bosonen en het Higgs-deeltje..
Ze hebben ook hun respectievelijke antideeltjes, die bij interactie vernietigen en nieuwe deeltjes genereren. Hier zijn er een aantal:
-Positron, identiek aan het elektron maar positief geladen.
-Neutrino, geen kosten.
-meson.
-Bosonen, die de dragers zijn van fundamentele interacties, behalve zwaartekracht.
-Het Higgs-deeltje, verantwoordelijk voor massa.
-Graviton, is een deeltje dat wordt voorgesteld om de zwaartekracht te verklaren, maar er is nog geen bewijs dat het bestaat.
Referenties
- Chang, R. 2013. Chemistry. 11e. Editie. Mc Graw Hill Education.
- Cobian, J. The Standard Model of Particles. Hersteld van: sne.es.
- Fernández de Sala, P. Elementaire deeltjes, composietdeeltjes en virtuele deeltjes. Hersteld van: ific.uv.es.
- Giambattista, A. 2010. Physics. 2e. Ed McGraw Hill.
- Olmo, M. Protonen en neutronen. Hersteld van: hyperphysics.phy-astr.gsu.edu.


Niemand heeft nog op dit artikel gereageerd.