
LDH-functies, bepaling, reactie, normale waarden
De lactaatdehydrogenase, Melkzuurdehydrogenase, NAD-afhankelijke lactaatdehydrogenase of kortweg LDH, is een enzym dat behoort tot de groep van oxidoreductases die in praktisch alle dierlijke en plantaardige weefsels en in veel micro-organismen zoals bacteriën, gisten en archaea wordt aangetroffen..
Enzymen van dit type worden aangeduid met het nummer EC 1.1.1.27 van de Enzyme Nomenclature Committee en zijn verantwoordelijk voor de reactie waarbij lactaat wordt omgezet in pyruvaat (door oxidatie) en vice versa (door reductie), waarbij nicotinamide-adenine-dinucleotiden (NAD + en NADH) in het proces dat bekend staat als melkzuurgisting.
In tegenstelling tot alcoholische fermentatie, die alleen voorkomt in sommige micro-organismen zoals gist en die glycolytisch pyruvaat gebruikt voor de productie van ethanol, vindt melkzuurfermentatie plaats in veel organismen en lichaamsweefsels van verschillende levende wezens..
Dit belangrijke enzym voor het celmetabolisme werd in de jaren veertig uit de skeletspier van de rat gekristalliseerd en tot op heden zijn de skeletspieren en het hartweefsel van zoogdieren de beste kenmerken..
Bij "hogere" dieren gebruikt het enzym het L-isomeer van lactaat (L-lactaat) voor de productie van pyruvaat, maar sommige "lagere" dieren en bacteriën produceren D-lactaat uit pyruvaat verkregen door glycolyse..
Lactaatdehydrogenase komt meestal voornamelijk tot expressie in weefsels of cellen onder anaërobe omstandigheden (met een lage bloedtoevoer) die bij mensen bijvoorbeeld karakteristiek kunnen zijn voor pathologische aandoeningen zoals kanker, lever of hartaandoeningen..
De omzetting van pyruvaat in lactaat is echter typerend voor de spieren tijdens inspanning en het hoornvlies van het oog, dat weinig zuurstof bevat..
Artikel index
- 1 Functies
- 2 Kenmerken en structuur
- 3 Bepaling
- 3.1 Door spectrofotometrie
- 3.2 Door immunohistochemie
- 3.3 Waarom bepalen lactaatdehydrogenase?
- 4 Reactie
- 5 Normale waarden
- 6 Wat betekent het om een hoge LDH te hebben?
- 7 referenties
Kenmerken
Lactaatdehydrogenase vervult meerdere functies in talrijke metabole routes. Het is het centrum van het delicate evenwicht tussen de katabole en anabole koolhydraatroutes.
Tijdens aërobe glycolyse, pyruvaat (het laatste product op de route per se) kan worden gebruikt als een substraat voor het pyruvaatdehydrogenase-enzymcomplex, waardoor het wordt gedecarboxyleerd, waardoor acetyl-CoA-moleculen vrijkomen die stroomafwaarts, metabolisch gezien, in de Krebs-cyclus worden gebruikt.
Bij anaërobe glycolyse daarentegen, produceert de laatste stap van glycolyse pyruvaat, maar dit wordt gebruikt door lactaatdehydrogenase om lactaat en NAD te produceren.+, dat herstelt de NAD+ die werd gebruikt tijdens de reactie gekatalyseerd door glyceraldehyde 3-fosfaat dehydrogenase.
Aangezien tijdens anaerobiose glycolyse de belangrijkste bron van energieproductie in de vorm van ATP is, speelt lactaatdehydrogenase een fundamentele rol bij de heroxidatie van NADH geproduceerd in eerdere stappen van de glycolytische route, essentieel voor het functioneren van andere verwante enzymen..
Lactaatdehydrogenase is ook betrokken bij de glycogenese die plaatsvindt in weefsels die lactaat omzetten in glycogeen en in sommige aërobe weefsels zoals het hart is lactaat een brandstof die opnieuw wordt geoxideerd om energie te produceren en het vermogen te verminderen in de vorm van ATP en NAD.+, respectievelijk.
Kenmerken en structuur
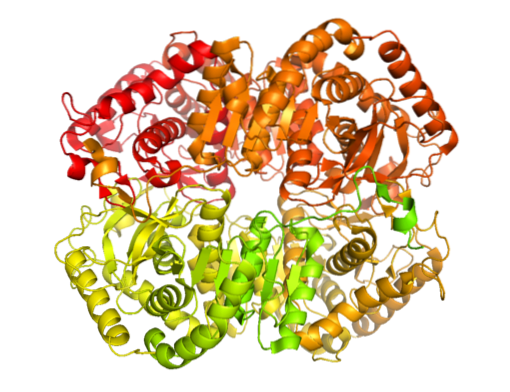
Er zijn meerdere moleculaire vormen van lactaatdehydrogenase in de natuur. Alleen bij dieren is vastgesteld dat er vijf lactaatdehydrogenase-activiteiten zijn, allemaal tetrameer en in wezen samengesteld uit twee soorten polypeptideketens die bekend staan als de H- en M-subeenheden (ze kunnen homo- of heterotetrameer zijn).
De H-vorm wordt meestal aangetroffen in hartweefsel, terwijl de M-vorm is gedetecteerd in skeletspieren. Beide ketens verschillen van elkaar in termen van overvloed, aminozuursamenstelling, kinetische eigenschappen en structurele eigenschappen..
De H- en M-vormen zijn het translationele product van verschillende genen, mogelijk gelokaliseerd op verschillende chromosomen, en die ook onder controle of regulatie staan van verschillende genen. De H-vorm is overheersend in weefsels met aëroob metabolisme en de M-vorm in anaëroob weefsel..
Een ander type nomenclatuur gebruikt de letters A, B en C voor de verschillende soorten enzymen bij zowel zoogdieren als vogels. Aldus staat spierlactaatdehydrogenase bekend als A4, het hart als B4 en een derde heet C4, die specifiek is voor de testikels.
De expressie van deze iso-enzymen wordt zowel ontwikkelingsafhankelijk als weefselafhankelijk gereguleerd..
Het enzym is geïsoleerd uit verschillende dierlijke bronnen en er is vastgesteld dat de tetramere structuur een gemiddeld molecuulgewicht heeft van ongeveer 140 kDa en dat de bindingsplaats voor NADH of in NAD+ bestaat uit een β-gevouwen plaat bestaande uit zes kettingen en 4 alfa-helices.
Bepaling
Door spectrofotometrie
De activiteit van lactaatdehydrogenase van dierlijke oorsprong wordt spectrofotometrisch bepaald in vitro door kleurveranderingmetingen als gevolg van het redoxproces dat plaatsvindt tijdens de omzettingsreactie van pyruvaat naar lactaat.
Metingen worden gedaan bij 340 nm met een spectrofotometer en de snelheid waarmee de optische dichtheid afneemt als gevolg van de oxidatie of "verdwijning" van NADH, dat wordt omgezet in NAD, wordt bepaald.+.
Dat wil zeggen, de bepaalde reactie is als volgt:
Pyruvaat + NADH + H+ → Lactaat + NAD+
De enzymatische meting moet worden uitgevoerd onder optimale omstandigheden van pH en concentratie van substraten voor het enzym, zodat er geen risico bestaat dat de hoeveelheid aanwezig in de monsters wordt onderschat door een tekort aan substraten of extreme omstandigheden van zuurgraad of basiciteit..
Door immunohistochemie
Een andere, misschien wat modernere methode om de aanwezigheid van lactaatdehydrogenase vast te stellen, heeft te maken met het gebruik van immunologische instrumenten, dat wil zeggen met het gebruik van antilichamen..
Deze methoden profiteren van de affiniteit tussen de binding van een antigeen met een antilichaam dat er specifiek tegen is gegenereerd en zijn zeer nuttig voor de snelle bepaling van de aan- of afwezigheid van enzymen zoals LDH in een bepaald weefsel..
Afhankelijk van het doel moeten de gebruikte antilichamen specifiek zijn voor de detectie van een van de iso-enzymen of voor elk eiwit met lactaatdehydrogenase-activiteit..
Waarom bepalen lactaatdehydrogenase?
De bepaling van dit enzym wordt voor verschillende doeleinden uitgevoerd, maar voornamelijk voor de klinische diagnose van sommige aandoeningen, waaronder een hartinfarct en kanker..
Op cellulair niveau wordt de afgifte van lactaatdehydrogenase beschouwd als een van de parameters om het optreden van necrotische of apoptotische processen te bepalen, aangezien het plasmamembraan permeabel wordt..
De producten van de reactie die het katalyseert, kunnen ook in een weefsel worden bepaald om te bepalen of om een bepaalde reden een anaëroob metabolisme overheerst..
Reactie
Zoals aanvankelijk vermeld, is het enzym lactaatdehydrogenase, waarvan de systematische naam (S) -lactaat: NAD+ dehydrogenase, katalyseert de omzetting van lactaat in pyruvaat in de NAD-vorm+ afhankelijk, of vice versa, die optreedt dankzij de overdracht van een hydride-ion (H.-) van pyruvaat tot lactaat of van NADH tot geoxideerd pyruvaat.

De NAD+ Het heeft een ADP-eenheid en een andere nucleotidegroep afgeleid van nicotinezuur, ook wel niacine of vitamine B genoemd3, en dit co-enzym neemt deel aan meerdere reacties van groot biologisch belang.
Het is belangrijk op te merken dat het evenwicht in deze reactie verschuift naar de lactaatzijde en het is aangetoond dat het enzym ook in staat is om andere zuren te oxideren (S) -2-hydroxymonocarboxylen en gebruiken, hoewel minder efficiënt, NADP+ als substraat.
Afhankelijk van het betrokken lichaamsgebied en tegelijkertijd van de metabolische kenmerken ervan in relatie tot de aan- of afwezigheid van zuurstof, produceren weefsels verschillende hoeveelheden lactaat, het product van de reactie dat wordt gekatalyseerd door LDH..
Als we bijvoorbeeld een rode bloedcel (erytrocyt) beschouwen die mitochondriën mist die pyruvaat dat tijdens glycolyse wordt geproduceerd, kan metaboliseren tot COtwee en water, dan zou je kunnen zeggen dat dit de belangrijkste lactaatproducerende cellen in het menselijk lichaam zijn, aangezien al het pyruvaat wordt omgezet in lactaat door de werking van lactaatdehydrogenase.
Aan de andere kant zijn levercellen en skeletspiercellen verantwoordelijk voor de productie van een minimale hoeveelheid lactaat, aangezien dit snel wordt gemetaboliseerd..
Normale waarden
De concentratie van lactaatdehydrogenase in het bloedserum is het product van de expressie van verschillende iso-enzymen in onder meer de lever, het hart, de skeletspieren, erytrocyten en tumoren..
In bloedserum liggen de normale bereiken van lactaatdehydrogenase-activiteit tussen 260 en 850 U / ml (eenheden per milliliter), met een gemiddelde waarde van 470 ± 130 U / ml. Ondertussen hebben bloedhemolysaten een LDH-activiteit die varieert tussen 16.000 en 67.000 U / ml, wat overeenkomt met een gemiddelde van 34.000 ± 12.000 U / ml..
Wat betekent het om een hoge LDH te hebben??
De kwantificering van de lactaatdehydrogenaseconcentratie in het bloedserum heeft een belangrijke waarde bij de diagnose van sommige hartaandoeningen, lever, bloed en zelfs kanker..
Hoge niveaus van LDH-activiteit zijn gevonden bij patiënten met myocardinfarct (zowel experimenteel als klinisch), evenals bij kankerpatiënten, met name bij vrouwen met endometrium-, eierstok-, borst- en baarmoederkanker..
Afhankelijk van het specifieke isozym dat wordt aangetroffen in "overmaat" of hoge concentratie, wordt kwantificering van lactaatdehydrogenase-iso-enzymen door veel behandelende artsen gebruikt voor het bepalen van weefselschade (ernstig of chronisch)..
Referenties
- Bergmeyer, H., Bernt, E., & Hess, B. (1961). Melkzuurdehydrogenase. Methoden voor enzymatische analyse. Verlag Chemie, GmbH.
- Chung, F., Tsujubo, H., Bhattacharyya, U., Sharief, F., & Li, S. (1985). Genomische organisatie van menselijk lactaatdehydrogenase-A-gen. Biochemical Journal, 231, 537-541.
- De Becker, D. (2003). Melkzuuracidose. Intensive Care MEd, 29, 699-702.
- Everse, J., en Kaplan, N. (1973). Lactaatdehydrogenasen: structuur en functie. In Vooruitgang in de enzymologie en aanverwante gebieden van moleculaire biologie (blz. 61-133).
- Fox, S. I. (2006). Menselijke fysiologie (9e ed.). New York, VS: McGraw-Hill Press.
- Huijgen, H., Sanders, G. T. B., Koster, R. W., Vreeken, J., & Bossuyt, P. M. M. (1997). De klinische waarde van lactaatdehydrogenase in serum: een kwantitatieve review. Eur J Clin Chem Clin Biochem, 35(8), 569-579.
- Nomenclatuurcomité van de Internationale Unie voor Biochemie en Moleculaire Biologie (NC-IUBMB). (2019). Opgehaald van www.qmul.ac.uk/sbcs/iubmb/enzyme/index.html
- Rawn, J. D. (1998). Biochemie. Burlington, Massachusetts: uitgeverij Neil Patterson.
- Usategui-Gomez, M., Wicks, R. W., en Warshaw, M. (1979). Immunochemische bepaling van het hartisoenzym van lactaatdehydrogenase (LDH1) in menselijk serum. Clin Chem, 25(5), 729-734.
- Wróblewski, F., & Ladue, J.S. (1955). Melkzuur degydrogenase-activiteit in bloed. Experimentele biologie en geneeskunde, 90, 210-215.



Niemand heeft nog op dit artikel gereageerd.