
Ritchter-Wenzel Law Verhalen, uitspraken en voorbeelden

De Ritchter-Wenzel wet of van de wederzijdse verhoudingen is er een die vaststelt dat de massaverhoudingen tussen twee verbindingen het mogelijk maken om die van een derde verbinding te bepalen. Het is een van de wetten van de stoichiometrie, samen met de wet van Lavoisier (wet van behoud van massa); De wet van Proust (wet van bepaalde proporties); en de wet van Dalton (wet van meerdere proporties).
Ritcher verkondigde zijn wet in 1792 in een boek dat de grondbeginselen van stoichiometrie definieerde, gebaseerd op het onderzoek van Carl F. Wenzel, die in 1777 de eerste equivalentietabel voor zuren en basen publiceerde..
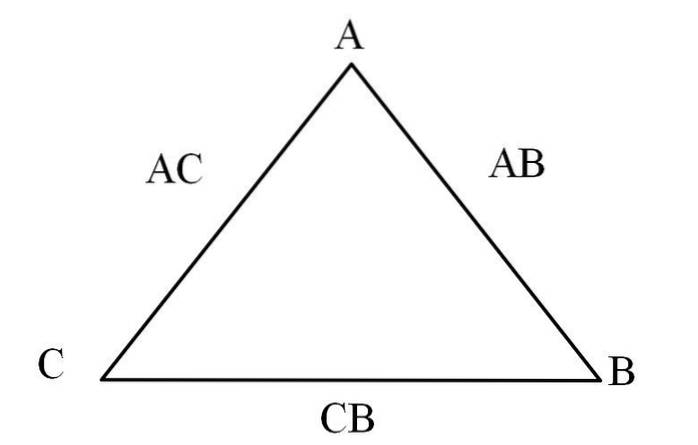
Een eenvoudige manier om het te visualiseren is door middel van een "driehoek van wederkerigheid" (afbeelding hierboven). Als u de massa van A, C en B kent die zich mengen om de verbindingen AC en AB te vormen, kunt u bepalen hoeveel van C en B zich mengen of reageren om verbinding CB te vormen..
In verbindingen AC en AB is element A in beide aanwezig, dus door hun massaverhoudingen te delen, zal blijken hoeveel C reageert met B.
Artikel index
- 1 Geschiedenis en algemeenheden van het recht van wederkerige proporties
- 2 Verklaringen en gevolgen
- 3 voorbeelden
- 3.1 Calciumchloride
- 3.2 Zwaveloxiden
- 3.3 IJzersulfide en oxide
- 4 referenties
Geschiedenis en algemeenheden van de wet van wederzijdse proporties
Richter ontdekte dat de gewichtsverhouding van de verbindingen die in een chemische reactie worden verbruikt, altijd hetzelfde is.
In dit verband ontdekte Ritcher dat er bijvoorbeeld 615 gewichtsdelen magnesiumoxide (MgO) nodig zijn om 1000 gewichtsdelen zwavelzuur te neutraliseren..
Tussen 1792 en 1794 publiceerde Ritcher een driedelige samenvatting met zijn werk over de wet van bepaalde proporties. Het abstract behandelde stoichiometrie en definieerde het als de kunst van chemische metingen..
Verder opmerkend dat stoichiometrie betrekking heeft op de wetten volgens welke stoffen zich verenigen om verbindingen te vormen. Het onderzoekswerk van Richter werd echter bekritiseerd vanwege de wiskundige behandeling die hij gebruikte, en er werd zelfs op gewezen dat hij zijn resultaten aanpaste.
In 1802 publiceerde Ernst Gottfried Fischer de eerste tabel met chemische equivalenten, waarin zwavelzuur werd gebruikt met een getal van 1000; vergelijkbaar met de waarde gevonden door Richter, voor de neutralisatie van zwavelzuur door magnesiumoxide.
Er is echter opgemerkt dat Richter een tabel met combinatiegewichten opstelde die de snelheid aangaf waarmee een aantal verbindingen reageerde. Er wordt bijvoorbeeld gesteld dat 859 delen NaOH 712 delen HNO neutraliseren3.
Verklaringen en gevolgen
De bewering van de Wet van Richter-Wenzel is de volgende: de massa's van twee verschillende elementen die worden gecombineerd met dezelfde hoeveelheid van een derde element, behouden dezelfde relatie als de massa's van die elementen wanneer ze met elkaar worden gecombineerd.
Deze wet maakte het mogelijk om het equivalentgewicht, of gewicht-equivalent-gram, vast te stellen als de hoeveelheid van een element of verbinding die zal reageren met een vaste hoeveelheid van een referentiestof.
Richter noemde combinatiegewichten in verhouding tot de gewichten van de elementen die gecombineerd zijn met elke gram waterstof. De relatieve combinatiegewichten van Richter komen overeen met wat momenteel bekend staat als het equivalentgewicht van de elementen of verbindingen.
In overeenstemming met de vorige benadering kan de wet van Richter-Wenzel als volgt worden uitgedrukt:
De combinatiegewichten van verschillende elementen die worden gecombineerd met een bepaald gewicht van een bepaald element zijn de relatieve combinatiegewichten van die elementen wanneer ze met elkaar worden gecombineerd, of veelvouden of deelvouden van deze kwantiteitsrelaties.
Voorbeelden
Calciumchloride
In calciumoxide (CaO) wordt 40 g calcium gecombineerd met 16 g zuurstof (O). Ondertussen, in hypochloorzuuroxide (CltweeO), wordt 71 g chloor gecombineerd met 16 g zuurstof. Welke verbinding zou calcium maken in combinatie met chloor??
Met behulp van de driehoek van wederkerigheid is zuurstof het gemeenschappelijke element voor de twee verbindingen. De massaverhoudingen van de twee oxygenaten worden eerst bepaald:
40 g Ca / 16 g O = 5 g Ca / 2 g O
71 g Cl / 16 g O
En nu de twee massaverhoudingen van CaO en Cl delentweeOf we hebben:
(5 g Ca / 2 g O) / (71 g Cl / 16 g O) = 80 g Ca / 142 g Cl = 40 g Ca / 71 g Cl
Merk op dat aan de wet van massaverhoudingen is voldaan: 40 g calcium reageert met 71 g chloor.
Zwaveloxiden
Zuurstof en zwavel reageren met koper om respectievelijk koperoxide (CuO) en kopersulfide (CuS) te geven. Hoeveel zwavel zou reageren met zuurstof?
In koperoxide wordt 63,5 g koper gecombineerd met 16 g zuurstof. In kopersulfide bindt 63,5 g koper zich aan 32 g zwavel. We delen de massaverhoudingen die we hebben:
(63,5 g Cu / 16 g O) / (63,5 g Cu / 32 g S) = 2032 g S / 1016 g O = 2 g S / 1 g O
De massaverhouding van 2: 1 is een veelvoud van 4 (63,5 / 16), wat aangeeft dat de wet van Richter waar is. Met deze verhouding, SO, wordt zwavelmonoxide verkregen (32 g zwavel reageert met 16 g zuurstof).
Als je deze verhouding door twee deelt, krijg je 1: 1. Nogmaals, het is nu een veelvoud van 4 of 2, en daarom gaat het om de SOtwee, zwaveldioxide (32 g zwavel reageert met 32 g zuurstof).
IJzersulfide en oxide
IJzersulfide (FeS), waarin 32 g zwavel wordt gecombineerd met 56 g ijzer, wordt omgezet met ferrooxide (FeO), waarin 16 g zuurstof wordt gecombineerd met 56 g ijzer. Dit item dient als referentie.
In de reagerende verbindingen FeS en FeO worden zwavel (S) en zuurstof (O) ten opzichte van ijzer (Fe) aangetroffen in de verhouding 2: 1. In zwaveloxide (SO) wordt 32 g zwavel gecombineerd met 16 g zuurstof, zodat zwavel en zuurstof in de verhouding 2: 1 zijn.
Dit geeft aan dat aan de wet van wederzijdse verhoudingen of de wet van Richter is voldaan.
De gevonden verhouding tussen zwavel en zuurstof in zwaveloxide (2: 1) zou bijvoorbeeld kunnen worden gebruikt om te berekenen hoeveel zuurstof reageert met 15 g zwavel.
g zuurstof = (15 g S) ∙ (1 g O / 2 g S) = 7,5 g
Referenties
- Foist L. (2019). Wet van wederzijdse proportie: definitie en voorbeelden. Studie. Hersteld van: study.com
- Cyber-taken. (2016, 9 februari). Wet van wederzijdse verhoudingen of Richter-Wenzel. Hersteld van: cibertareas.infol
- Wikipedia. (2018). Wet van wederzijdse verhoudingen. Hersteld van: en.wikipedia.org
- J.R. Partington M.B.E. D.Sc. (1953) Jeremias Benjamin Richter en de wet van wederkerige proporties. -II, Annals of Science, 9: 4, 289-314, DOI: 10.1080 / 00033795300200233
- Shrestha B. (18 juni 2015). Wet van wederzijdse verhoudingen. Chemie Libretexts. Hersteld van: chem.libretexts.org
- Kennis opnieuw definiëren. (29 juli 2017). Wet van wederzijdse verhoudingen. Hersteld van: hemantmore.org.in


Niemand heeft nog op dit artikel gereageerd.