
Ferrometalen structuur, typen, kenmerken

De ijzerhoudend metaal Ze bevatten ijzer (Fe), evenals kleine hoeveelheden andere metalen die worden toegevoegd om bepaalde gunstige eigenschappen aan hun legeringen te geven. Hoewel ijzer in verschillende oxidatietoestanden kan voorkomen, zijn +2 (ferro) en +3 (ferri) de meest voorkomende.
De term "ferro" verwijst echter naar de aanwezigheid van ijzer, ongeacht de oxidatietoestand ervan in het materiaal. IJzer is het vierde meest voorkomende element in de aardkorst, maar wereldwijd is het het belangrijkste aarde-element. Daarom hebben ferrometalen historisch en industrieel een rol gespeeld in de evolutie van de mens..

Dit was het geval vanwege zijn grote overvloed en aanpasbare eigenschappen. Deze ferrometalen beginnen bij de winning van ijzer uit mineralogische bronnen, zoals: hematiet (FetweeOF3), magnetiet (Fe3OF4) en sideriet (FeCO3Vanwege hun prestaties zijn deze oxiden het meest gewenst bij de ijzerverwerking.
De bovenste afbeelding toont een gloeiende gietijzeren "tong van vuur". Van alle ferrometalen bestaat de belangrijkste uit een ijzerlegering waaraan kleine hoeveelheden koolstof zijn toegevoegd: staal..
Artikel index
- 1 Structuur
- 2 Kenmerken en eigenschappen
- 3 voorbeelden
- 3.1 Smeedijzer of zacht ijzer
- 3.2 Ruw ijzer of ruw ijzer
- 3.3 Zuiver ijzer
- 3.4 Gietijzer of gietijzer (gieterijen)
- 3.5 Grijs ijzer
- 3.6 Nodulair gietijzer
- 3.7 Staalsoorten
- 4 Staal en zijn toepassingen
- 4.1 Koolstof- of constructiestaal
- 4.2 Siliciumstaal
- 4.3 Gegalvaniseerd staal
- 4.4 Roestvrij staal
- 4.5 Mangaanstaal
- 4.6 Invar-staal
- 5 referenties
Structuur
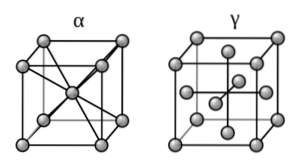
Omdat ijzer het hoofdbestanddeel is van ferrometalen, bestaan hun structuren uit kristallijne vervormingen van hun zuivere vaste stof.
Bijgevolg zijn ferrolegeringen zoals staal niets meer dan de interstitiële opname van andere atomen in de kristalrangschikking van ijzer..
Wat is dit arrangement? IJzer vormt allotropen (verschillende vaste structuren) afhankelijk van de temperatuur waaraan het wordt blootgesteld, waardoor de magnetische eigenschappen ervan veranderen. Dus bij kamertemperatuur presenteert het een bcc-opstelling, ook bekend als alfa-ijzer (de kubus aan de linkerkant, bovenste afbeelding).
Aan de andere kant, in een reeks van hoge temperaturen (912-1394 (ºC)), manifesteert het de opstelling ccp of fcc: het ijzer-gamma (de kubus aan de rechterkant). Zodra deze temperatuur wordt overschreden, keert het ijzer terug naar de bcc-vorm om uiteindelijk te smelten.
Deze verandering in alfa-gamma-structuur staat bekend als fasetransformatie. De gammafase is in staat koolstofatomen te 'vangen', terwijl de alfafase dat niet is.
In het geval van staal kan de structuur dus worden gevisualiseerd als sets ijzeratomen die een koolstofatoom omringen..
Op deze manier hangt de structuur van ferrometalen af van de verdeling van de fasen van ijzer en de atomen van andere soorten in de vaste stof..
Kenmerken en eigenschappen
Zuiver ijzer is een zacht en zeer taai metaal, zeer gevoelig voor corrosie en oxidatie door externe factoren. Wanneer het echter verschillende verhoudingen van een ander metaal of koolstof bevat, krijgt het nieuwe kenmerken en eigenschappen..
In feite zijn het deze veranderingen die ferrometalen nuttig maken voor talloze toepassingen..
Ferrolegeringen zijn over het algemeen sterk, duurzaam en taai, met heldere grijsachtige kleuren en magnetische eigenschappen..
Voorbeelden
Smeedijzer of zoet
Het heeft een koolstofgehalte van minder dan 0,03%. Het is zilver van kleur, roest gemakkelijk en barst van binnen. Bovendien is het taai en vormbaar, een goede geleider van elektriciteit en moeilijk te lassen..
Het is het type ferrometaal dat de mens voor het eerst gebruikte bij de vervaardiging van wapens, gebruiksvoorwerpen en gebouwen. Het wordt momenteel gebruikt in platen, klinknagels, hekjes, enz. Omdat het een goede elektrische geleider is, wordt het gebruikt in de kern van elektromagneten.
Ruw ijzer of gietijzer
In het oorspronkelijke hoogovenproduct bevat het 3-4% koolstof en sporen van andere elementen zoals silicium, magnesium en fosfor. Het belangrijkste gebruik ervan is om in te grijpen bij de productie van andere ferrometalen.
Puur ijzer
Het is een grijsachtig wit metaal met magnetische eigenschappen. Ondanks zijn hardheid is het broos en broos. Het smeltpunt is hoog (1500 ºC.) En oxideert snel.
Het is een goede elektrische geleider en daarom wordt het gebruikt in elektrische en elektronische componenten. Anders heeft het weinig zin.
Gietijzer of gietijzer (gieterijen)
Ze hebben een hoog koolstofgehalte (tussen 1,76% en 6,67%). Ze zijn harder dan staal, maar brozer. Ze smelten bij een lagere temperatuur dan puur ijzer, rond de 1100 ºC.
Omdat het vormbaar is, is het mogelijk om er stukken van verschillende afmetingen en complexiteit mee te vervaardigen. Bij dit type ijzer wordt grijs gietijzer gebruikt, wat het stabiliteit en vormbaarheid geeft..
Ze zijn beter bestand tegen corrosie dan staal. Ze zijn ook goedkoop en compact. Ze vertonen vloeibaarheid bij relatief lage temperaturen, omdat ze de mallen kunnen vullen.
Ze hebben ook goede compressie-eigenschappen, maar zijn bros en breken voordat ze buigen, dus ze zijn niet geschikt voor zeer ingewikkelde stukken..
grijs ijzer
Het is het meest voorkomende gietijzer, de grijze tint is te wijten aan de aanwezigheid van grafiet. Het heeft een koolstofconcentratie tussen 2,5% en 4%; Bovendien bevat het 1-3% siliconen om het grafiet te stabiliseren.
Het heeft veel van de kenmerken van standaard gietijzers, omdat het zeer vloeibaar is. Het is niet flexibel en buigt kort voordat het breekt.
Nodulair gietijzer
Koolstof wordt toegevoegd, in de vorm van bolvormig graniet, in een concentratie tussen 3,2% en 3,6%. De bolvorm van grafiet geeft het een grotere slagvastheid en kneedbaarheid dan grijs ijzer, waardoor het kan worden gebruikt in gedetailleerde en scherpe ontwerpen.
Staalsoorten
Koolstofgehalte tussen 0,03% en 1,76%. Tot de eigenschappen behoren hardheid, vasthoudendheid en weerstand tegen fysieke inspanningen. Over het algemeen roesten ze gemakkelijk. Ze zijn lasbaar en kunnen in het smeedwerk of machinaal worden verwerkt.
Ze hebben ook een grotere hardheid en minder vloeibaarheid dan gietijzers. Om deze reden hebben ze hoge temperaturen nodig om in de mallen te stromen..
Staal en zijn toepassingen

Er zijn verschillende soorten staal met elk verschillende toepassingen:
Koolstof- of constructiestaal
De koolstofconcentratie kan variëren, waardoor vier vormen ontstaan: zacht staal (0,25% koolstof), halfzoet staal (0,35% koolstof), halfhard staal (0,45% koolstof) en hard (0,5%).
Het wordt gebruikt bij de vervaardiging van gereedschappen, staalplaten, spoorvoertuigen, spijkers, schroeven, auto's en boten.
Silicium staal
Ook wel elektrisch staal of magnetisch staal genoemd. De siliciumconcentratie varieert tussen 1% en 5%, Fe varieert tussen 95% en 99% en koolstof heeft 0,5%.
Bovendien worden kleine hoeveelheden mangaan en aluminium toegevoegd. Het heeft een grote hardheid en een hoge elektrische weerstand. Het wordt gebruikt bij de vervaardiging van magneten en elektrische transformatoren.
Gegalvaniseerd staal
Het is bedekt met een zinklaag die het beschermt tegen roest en corrosie. Daarom is het handig voor het maken van pijponderdelen en gereedschappen..
Roestvrij staal
Het heeft een samenstelling van Cr (14-18%), Ni (7-9%), Fe (73-79%) en C (0,2%). Het is bestand tegen oxidatie en corrosie. Het wordt gebruikt bij de productie van bestek en snijmateriaal.
Mangaanstaal
De samenstelling is Mn (10-18%), Fe (82-90%) en C (1,12%). Het is hard en slijtvast. Gebruikt op treinrails, kluizen en bepantsering.
Invar staal
Het heeft 36% Ni, 64% Fe en 0,5% koolstof. Het heeft een lage uitzettingscoëfficiënt. Het wordt gebruikt bij de constructie van indicatorschalen; bijvoorbeeld: meetlinten.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. 8e editie, CENGAGE Learning.
- Beheerder. (19 september 2017). Wat is ijzer, waar komt het vandaan en hoeveel soorten ijzer zijn er. Opgehaald op 22 april 2018, van: termiser.com
- Wikipedia. (2018). Ijzer. Opgehaald op 22 april 2018, van: en.wikipedia.org
- Metalen. Algemene eigenschappen. Extractie en classificatie van metalen. Opgehaald op 22 april 2018, van: edu.xunta.gal
- Jose Ferrer. (Januari 2018). Metalurgische karakterisering van ferro- en non-ferro materialen. Opgehaald op 22 april 2018, van: steemit.com
- Essays, VK. (November 2013). Basisstructuren van ferrometalen. Opgehaald op 22 april 2018, van: ukessays.com
- Cdang. (7 juli 2011). IJzer Alpha & Iron Gamma. [Figuur]. Opgehaald op 22 april 2018, van: commons.wikimedia.org
- Włodi. (15 juni 2008). Roestvrijstalen vlechten. [Figuur]. Opgehaald op 22 april 2018, van: commons.wikimedia.org



Niemand heeft nog op dit artikel gereageerd.