
Methyl- of methylgroep
De methyl- of methylgroep is een alkylsubstituent waarvan de chemische formule CH is3. Het is de eenvoudigste van alle koolstofsubstituenten in de organische chemie, het heeft een enkele koolstof en drie waterstofatomen; is afgeleid van methaangas. Omdat het alleen kan binden aan een andere koolstof, geeft zijn positie het einde van een ketting aan, zijn beëindiging.
In de onderstaande afbeelding is er een van de vele voorstellingen voor deze groep. De curven aan de rechterkant geven aan dat achter de H-link3C- kan elk atoom of substituent zijn; een alkyl, R, aromatisch of aryl, Ar, of een heteroatoom of functionele groep, zoals OH of Cl.

Wanneer de functionele groep die aan de methyl is gehecht OH is, hebben we de alcohol methanol, CH3OH; en als het Cl is, dan hebben we methylchloride, CH3Cl. In de organische nomenclatuur wordt het eenvoudigweg 'methyl' genoemd, voorafgegaan door het nummer van zijn positie in de langste koolstofketen.
De methylgroep CH3 is gemakkelijk te identificeren tijdens opheldering van organische structuren, vooral dankzij koolstof 13 nucleaire magnetische resonantiespectroscopie (C NMR13Hieruit worden, na sterke oxidaties, COOH-zuurgroepen verkregen, een synthetische route om carbonzuren te synthetiseren.
Artikel index
- 1 Vertegenwoordigingen
- 2 Structuur
- 3 Eigenschappen
- 4 Reactiviteit
- 4.1 Oxidaties
- 4.2 Ionen
- 4.3 Methyleringsreactie
- 5 referenties
Vertegenwoordigingen
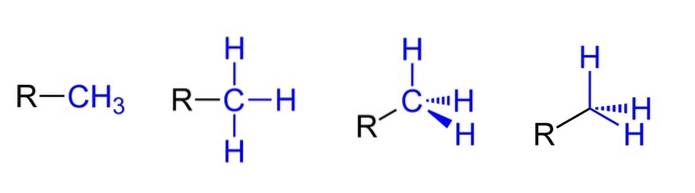
Hierboven hebben we de vier mogelijke representaties aangenomen dat de CH3 is gekoppeld aan een alkylsubstituent R.Alle zijn equivalent, maar als je van links naar rechts gaat, zijn de ruimtelijke aspecten van het molecuul duidelijk.
Bijvoorbeeld R-CH3 het wekt de indruk dat het vlak en lineair is. De volgende afbeelding toont de drie C-H covalente bindingen, waardoor de methyl kan worden geïdentificeerd in elke Lewis-structuur en de verkeerde indruk wekt een kruis te zijn..
Vervolgens, verder naar rechts (de voorlaatste), wordt de sp-hybridisatie waargenomen3 op de koolstof van CH3 vanwege zijn tetraëdrische geometrie. In de laatste weergave wordt het chemische symbool voor koolstof niet eens geschreven, maar de tetraëder wordt behouden om aan te geven welke H-atomen zich voor of achter het vlak bevinden..
Hoewel het niet in de afbeelding staat, een andere zeer terugkerende manier om de CH weer te geven3 het bestaat uit het simpelweg plaatsen van het koppelteken (-) "naakt". Dit is erg handig bij het tekenen van grote koolstofskeletten..
Structuur

De bovenste afbeelding is de driedimensionale weergave van de eerste. De glanzende zwarte bol komt overeen met het koolstofatoom, terwijl de witte de waterstofatomen zijn.
Nogmaals, koolstof heeft een tetraëdrisch omgevingsproduct van zijn sp-hybridisatie3, en als zodanig is het een relatief omvangrijke groep, met zijn C-R bindingsrotaties sterisch gehinderd; dat wil zeggen, het kan niet roteren omdat de witte bollen de elektronische wolken van hun naburige atomen zouden verstoren en hun afstoting zouden voelen.
De C-H-bindingen kunnen echter trillen, net als de C-R-binding. Daarom is de CH3 is een groep van tetraëdrische geometrie die kan worden opgehelderd (bepaald, vastgesteld) door infraroodstraling (IR) spectroscopie, zoals alle functionele groepen en koolstofbindingen met heteroatomen.
Het belangrijkste is echter de opheldering door C-NMR.13. Dankzij deze techniek wordt het relatieve aantal methylgroepen bepaald, waardoor de moleculaire structuur kan worden samengesteld..
Over het algemeen zijn de meer CH-groepen3 een molecuul hebben, des te "onhandiger" of inefficiënter zullen de intermoleculaire interacties zijn; dat wil zeggen, hoe lager hun smelt- en kookpunt zal zijn. CH-groepen3, vanwege hun waterstofatomen 'glijden' ze tegen elkaar aan als ze elkaar naderen of aanraken.
Eigendommen
De methylgroep wordt gekenmerkt doordat hij in wezen hydrofoob en apolair is.
Dit komt doordat hun C-H-bindingen niet erg polair zijn vanwege het kleine verschil tussen de elektronegativiteiten van koolstof en waterstof; Bovendien verdeelt zijn tetraëdrische en symmetrische geometrie zijn elektronendichtheden bijna homogeen, wat bijdraagt aan een verwaarloosbaar dipoolmoment..
Bij afwezigheid van polariteit, de CH3 Het "loopt weg" van water en gedraagt zich als een hydrofoob. Daarom, als het wordt gezien in een molecuul, zal het bekend zijn dat dit methyluiteinde niet efficiënt zal interageren met water of een ander polair oplosmiddel..
Een ander kenmerk van de CH3 is zijn relatieve stabiliteit. Tenzij het atoom dat eraan is gebonden zijn elektronische dichtheid verwijdert, blijft het praktisch inert voor zeer sterk zure media. Het zal echter worden gezien dat het kan deelnemen aan chemische reacties, voornamelijk met betrekking tot zijn oxidatie, of migratie (methylering) naar een ander molecuul..
Reactiviteit
Oxidaties
De CH3 het is niet vrijgesteld van roest. Dit betekent dat het vatbaar is voor het vormen van bindingen met zuurstof, C-O, als het reageert met sterke oxidatiemiddelen. Terwijl het oxideert, verandert het in verschillende functionele groepen.
De eerste oxidatie ervan geeft bijvoorbeeld aanleiding tot de methiol (of hydroxymethyl) groep, CHtweeOH, een alcohol. De tweede is afgeleid van de formylgroep, CHO (HC = O), een aldehyde. En de derde, ten slotte, maakt de omzetting mogelijk in de carboxylgroep, COOH, een carbonzuur.
Deze reeks oxidaties wordt gebruikt om benzoëzuur (HOOC-C6H.5) uit tolueen (H3DC6H.5.
Ion
De CH3 tijdens het mechanisme van sommige reacties kan het tijdelijke elektrische ladingen opwekken. Wanneer methanol bijvoorbeeld wordt verwarmd in een zeer sterk zuur medium, in de theoretische afwezigheid van nucleofielen (zoekers naar positieve ladingen), wordt het methylkation, CH3+, omdat de CH-binding is verbroken3-OH en de OH bladeren met het elektronenpaar van de binding.
De soort CH3+ het is zo reactief dat het alleen in de gasfase is bepaald, aangezien het reageert of verdwijnt bij de minste aanwezigheid van een nucleofiel.
Aan de andere kant is de CH3 een anion kan ook worden verkregen: methanide, CH3-, de eenvoudigste carbanion van allemaal. Echter, zoals de ch3+, zijn aanwezigheid is abnormaal en komt alleen voor onder extreme omstandigheden.
Methyleringsreactie
Bij de methyleringsreactie wordt een CH overgedragen3 naar een molecuul zonder elektrische ladingen te produceren (CH3+ noch CH3-) in het proces. Bijvoorbeeld methyljodide, CH3I, is een goed methyleringsmiddel en kan de O-H-binding van verschillende moleculen vervangen door een O-CH3.
Bij organische synthese brengt dit geen tragedie met zich mee; maar ja, wanneer wat in overmaat gemethyleerd is, de stikstofbasen van DNA zijn.
Referenties
- Morrison, R. T. en Boyd, R, N. (1987). Organische chemie. 5e editie. Redactioneel Addison-Wesley Interamericana.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10e editie.). Wiley plus.
- Rahul Gladwin. (23 november 2018). Methylering. Encyclopædia Britannica. Hersteld van: britannica.com
- Danielle Reid. (2019). Methylgroep: structuur en formule. Studie. Hersteld van: study.com
- Wikipedia. (2019). Methylgroep. Hersteld van: en.wikipedia.org



Niemand heeft nog op dit artikel gereageerd.