
Kenmerkende microfilamenten, structuur, functies, pathologie
De microfilamenten of actine-filamenten, zijn een van de drie fundamentele componenten van het cytoskelet van eukaryote cellen (microfilamenten, microtubuli en intermediaire filamenten) en zijn samengesteld uit kleine filamenten van een eiwit dat actine wordt genoemd (actinepolymeren).
In eukaryoten zijn de genen die coderen voor actine-microfilamenten in hoge mate geconserveerd in alle organismen, daarom worden ze vaak gebruikt als moleculaire markers voor verschillende soorten studies.

Microfilamenten worden door het cytosol gedistribueerd, maar zijn vooral overvloedig aanwezig in het gebied onder het plasmamembraan, waar ze een complex netwerk vormen en zich associëren met andere speciale eiwitten om het cytoskelet te vormen..
Microfilamentnetwerken in het cytoplasma van zoogdiercellen worden gecodeerd door twee van de zes genen beschreven voor actine, die betrokken zijn bij de dynamiek van microfilamenten en zelfs erg belangrijk zijn tijdens stamceldifferentiatie.
Veel auteurs zijn het erover eens dat microfilamenten de meest diverse, veelzijdige en belangrijke eiwitten zijn in het cytoskelet van de meeste eukaryote cellen, en het is belangrijk om te onthouden dat deze niet worden aangetroffen in prokaryote micro-organismen..
In dit type cellen zijn er daarentegen filamenten die homoloog zijn aan microfilamenten, maar die zijn opgebouwd uit een ander eiwit: het MreB-eiwit..
Momenteel wordt aangenomen dat het gen dat voor dit eiwit codeert, een mogelijk voorouderlijk gen is voor eukaryoot actine. De sequentiehomologie van de aminozuren waaruit het MreB-eiwit bestaat, is echter slechts 15% met betrekking tot de actine-sequentie..
Omdat ze een fundamenteel onderdeel zijn van het cytoskelet, kan elk fenotypisch defect in zowel microtubuli als intermediaire filamenten en actine-microfilamenten (cytoskelet) verschillende cellulaire en systemische pathologieën veroorzaken..
Artikel index
- 1 Kenmerken en structuur
- 1.1 Organisatie
- 2 Hoe worden actinefilamenten gevormd?
- 2.1 Regelgeving
- 3 functies
- 3.1 Voorbeeld van functies in de lever
- 4 Gerelateerde pathologieën
- 5 referenties
Kenmerken en structuur
Microfilamenten bestaan uit eiwitmonomeren van de actinefamilie, die zeer overvloedige contractiele eiwitten zijn in eukaryote cellen, aangezien ze ook deelnemen aan spiercontractie..
Deze filamenten hebben een diameter tussen 5 en 7 nm, dus ze worden ook wel dunne filamenten genoemd en bestaan uit twee vormen van actine: de bolvorm (G actine) en de filamenteuze vorm (F actine)..
De eiwitten die deelnemen aan het cytoskelet staan bekend als γ- en β-actines, terwijl degenen die deelnemen aan contractie meestal α-actines zijn..
Het aandeel van globulair actine en filamenteus actine in het cytosol hangt af van de cellulaire behoeften, aangezien microfilamenten zeer variabele en veelzijdige structuren zijn, die voortdurend groeien en verkorten door polymerisatie en depolymerisatie..
G-actine is een klein bolvormig eiwit, bestaande uit bijna 400 aminozuren en met een molecuulgewicht van ongeveer 43 kDa.
De G-actine-monomeren waaruit de microfilamenten bestaan, zijn gerangschikt in de vorm van een spiraalvormige streng, aangezien elk een twist ondergaat wanneer ze worden geassocieerd met de volgende.
G-actine associeert zich met één molecuul Ca2 + en een ander met ATP, die de bolvorm ervan stabiliseren; terwijl F-actine wordt verkregen na hydrolyse van het terminale fosfaat van het ATP-molecuul tot G-actine, wat bijdraagt aan polymerisatie.
Organisatie
Actinefilamenten kunnen worden georganiseerd in "bundels" of "netwerken" die verschillende functies binnen cellen hebben. De bundels vormen parallelle structuren die met elkaar zijn verbonden door tamelijk stijve kruisbruggen.
Netwerken zijn daarentegen lossere structuren, zoals driedimensionale mazen met de eigenschappen van halfvaste gels..
Er zijn veel eiwitten die worden geassocieerd met actinefilamenten of microfilamenten en staan bekend als ABP (uit het Engels actine-bindende eiwitten), die er specifieke sites voor hebben.
Veel van deze eiwitten laten microfilamenten een interactie aangaan met de andere twee componenten van het cytoskelet: microtubuli en tussenliggende filamenten, evenals met de andere componenten van de binnenkant van het plasmamembraan..
Andere eiwitten waarmee microfilamenten een interactie aangaan, zijn onder meer nucleaire laminae en spectrine (in rode bloedcellen).
Hoe worden actinefilamenten gevormd?
Omdat bolvormige actinemonomeren altijd op dezelfde manier binden, in dezelfde richting georiënteerd, hebben microfilamenten een gedefinieerde polariteit, met twee uiteinden: een "meer" en een "minder"..
De polariteit van deze filamenten is erg belangrijk, omdat ze aanzienlijk sneller groeien aan hun positieve uiteinde, waar de nieuwe G-actine-monomeren worden toegevoegd..

Het eerste dat plaatsvindt tijdens de polymerisatie van actinefilamenten is een proces dat bekend staat als "nucleatie", dat bestaat uit de associatie van drie monomeren van het eiwit.
Aan dit trimeer worden aan beide uiteinden nieuwe monomeren toegevoegd, zodat het filament groeit. G-actine-monomeren zijn in staat ATP met elke binding te hydrolyseren, wat implicaties heeft voor de polymerisatiesnelheid, aangezien actine-ATP-eenheden moeilijker dissociëren dan actine-ADP-eenheden..
ATP is niet nodig voor polymerisatie en de specifieke rol van de hydrolyse ervan is nog niet opgehelderd..
Sommige auteurs zijn van mening dat, aangezien actinepolymerisatiegebeurtenissen snel omkeerbaar zijn, het ATP dat met deze processen is geassocieerd tot 40% van de totale cellulaire omzet van dit energiemolecuul kan vertegenwoordigen..
Regulatie
Zowel de polymerisatie van actine-filamenten als hun depolymerisatie zijn processen die sterk worden gereguleerd door een reeks specifieke eiwitten, die verantwoordelijk zijn voor de hermodellering van de filamenten..
Een voorbeeld van de eiwitten die depolymerisatie reguleren, is de actine-depolymerisatiefactor cofilin. Een ander eiwit, profilin, heeft een tegenovergestelde functie, omdat het de associatie van monomeren stimuleert (door de uitwisseling van ADP voor ATP te stimuleren).
Kenmerken
Microfilamenten werken samen met myosinefilamenten die zijn geassocieerd met transmembraaneiwitten die een domein hebben in het cytosol en een ander aan de buitenkant van de cel, waardoor ze deelnemen aan de processen van celmobiliteit.
Deze microfilamenten geassocieerd met het plasmamembraan mediëren verschillende cellulaire reacties op verschillende klassen van stimuli. Celadhesie in epitheelweefsels wordt bijvoorbeeld aangestuurd door transmembraaneiwitten die bekend staan als cadherines, die een interactie aangaan met microfilamenten om responsfactoren te rekruteren..
Actine-filamenten werken samen met intermediaire filamenten om ervoor te zorgen dat extracellulaire stimuli worden overgedragen naar belangrijke locaties zoals ribosomen en chromosomen in de kern..
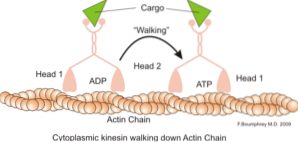
Een klassieke en veel bestudeerde functie van microfilamenten is hun vermogen om "bruggen", "rails" of "snelwegen" te vormen voor de beweging van het motoreiwit myosine I, dat in staat is transportblaasjes van organellen naar het membraanplasmatische in de secretie te laden paden.
Microfilamenten werken ook samen met myosine II om de samentrekkende ring vast te stellen die ontstaat tijdens cytokinese, precies tijdens de laatste fase van celdeling waarin het cytosol wordt gescheiden van stam- en dochtercellen..
In het algemeen moduleren F-actine-microfilamenten de distributie van sommige organellen zoals het Golgi-complex, endoplasmatisch reticulum en mitochondriën. Bovendien nemen ze ook deel aan de ruimtelijke positionering van mRNA's, zodat ze worden gelezen door ribosomen..
De hele cellulaire set van microfilamenten, vooral die die nauw verwant zijn aan het plasmamembraan, nemen deel aan de vorming van de golvende membranen van cellen die een constante actieve beweging hebben.
Ze zijn ook betrokken bij de vorming van microvilli en andere veel voorkomende hobbels op het oppervlak van veel cellen..
Voorbeeld van functies in de lever
Microfilamenten nemen deel aan het galafscheidingsproces in hepatocyten (levercellen) en ook aan peristaltische bewegingen (gecoördineerde contractie) van de hepatische canaliculi.
Ze dragen bij tot de differentiatie van plasmamembraandomeinen dankzij hun associatie met verschillende cytosolische elementen en de controle die ze uitoefenen over de topografie van deze intracellulaire elementen..
Gerelateerde pathologieën
Er zijn weinig ziekten die verband houden met primaire defecten in de structuur of met regulerende eiwitten en enzymen bij de synthese van microfilamenten, ondanks het feit dat deze direct betrokken zijn bij een groot aantal functies..
Het lage aantal ziekten en misvormingen in de primaire structuur van microfilamenten is te wijten aan het feit dat er over het algemeen meerdere genen zijn die coderen voor zowel actine als zijn regulerende eiwitten, een fenomeen dat bekend staat als 'genetische redundantie'..
Een van de meest bestudeerde pathologieën is de vitrificatie van de eicellen op hun cytoskelet, waarbij een onderbreking in het netwerk van corticale microfilamenten wordt waargenomen, evenals een depolymerisatie en desorganisatie van de microtubuli van de mitotische spoel..
In algemene termen veroorzaakt deze verglazing een chromosomale dispersie, aangezien het leidt tot een verstoring van de verdichting van al het chromatine.
De cellen met een grotere organisatie en een groter aandeel van microfilamenten in hun cytoskelet zijn de cellen van de dwarsgestreepte spier, daarom zijn de meeste pathologieën geassocieerd met een storing van het contractiele apparaat.
Defecte of atypische microfilamenten zijn ook in verband gebracht met de botziekte die bekend staat als de ziekte van Paget..
Referenties
- Aguilar-Cuenca, R., Llorente-González, C., Vicente, C., en Vicente-Manzanares, M. (2017). Microfilament-gecoördineerde adhesiedynamiek stimuleert de migratie van één cel en vormt hele weefsels. F1000Research, 6.
- Dos Remedios, C. G., Chhabra, D., Kekic, M., Dedova, I. V., Tsubakihara, M., Berry, D. A., & Nosworthy, N. J. (2003). Actinebindende eiwitten: regulatie van cytoskeletale microfilamenten. Fysiologische beoordelingen, 83(2), 433-473.
- Guo, H., Fauci, L., Shelley, M., & Kanso, E. (2018). Bistabiliteit bij de synchronisatie van aangedreven microfilamenten. Journal of Fluid Mechanics, 836, 304-323.
- Lanza, R., Langer, R., & Vacanti, J. P. (Eds.). (2011). Principes van tissue engineering. Academische pers.
- Robbins, J. (2017). Ziekten van het cytoskelet: de desminopathieën. In cardioskeletale myopathieën bij kinderen en jonge volwassenen (pp. 173-192). Academische pers.



Niemand heeft nog op dit artikel gereageerd.