
Myosine-kenmerken, structuur, typen en functie
De myosine het is een moleculaire motor, proteïne in de natuur, die in staat is zich voort te bewegen op actinefilamenten in het cytosol. De energie die de verplaatsing van myosine aandrijft, is afkomstig van de hydrolyse van ATP. Daarom wordt myosine vaak gedefinieerd als een mechanochemisch enzym.
In eukaryoten is myosine een zeer overvloedig eiwit. Er zijn verschillende klassen myosine, die worden gecodeerd door een familie van genen. Bij gisten worden 5 klassen onderscheiden, bij zoogdieren zijn er tientallen beschreven.
Myosin heeft een breed scala aan functies. Myosin I neemt, samen met actine, deel aan de beweging van keratocyten.
Myosin II zorgt voor stijfheid van het plasmamembraan, neemt deel aan cytokinese en spiercontractie. Beide myosinen I en II werken samen met celmigratie. Myosinen I en V voeren vesikeltransport uit langs actinefilamenten.
Artikel index
- 1 Structuur
- 2 kenmerken
- 3 functies
- 3.1 Spiercontractie
- 3.2 Cytokinese
- 3.3 Versteviging van de corticale membranen
- 3.4 Celadhesie
- 3.5 Verplaatsing van sommige blaasjes
- 4 Ziekten gerelateerd aan myosine
- 4.1 Myosins en gehoorverlies
- 4.2 Myosin X en kanker
- 5 referenties
Structuur
In elektronenmicrofoto's heeft de typische structuur van myosine-isovormen drie domeinen: hoofd, nek en staart. Door hydrolyse met chymotrypsine wordt een segment verkregen dat bestaat uit het hoofd en de nek, genaamd zware meromyosine (HMM), en een segment van de staart, genaamd lichte meromyosine (LMM)..
Het hoofddomein is het N-terminale uiteinde van de zware keten en het staartdomein is het C-terminale uiteinde van de lichte keten.
De klassen van myosine kunnen worden gedifferentieerd door het aantal polypeptideketens waaruit het bestaat, en de overvloed en klasse van lichte keten die aan de nek is bevestigd..
Myosine I heeft een polypeptideketen, die een kop vormt en zijn staart mist alfa-helixgebieden. Terwijl myosinen I en V twee polypeptideketens hebben en daarom twee koppen en een staart vormen, waarin de spiraalvormige alfaketens opgerold zijn om een staafachtige structuur te vormen.
Myosine I en V hebben bindingsplaatsen voor calmoduline, dat Ca reguleert en bindt+twee, op lichte kettingen. Myosin I fixeert Ca+twee in lichte ketens, maar doet het anders dan calmoduline.
Kenmerken
Op mechanochemisch niveau hebben myosinen drie kenmerken, namelijk:
- De myosinekop is het motorische domein dat in discrete stappen vooruitgaat: de vereniging van de myosinekop met een actinefilament, de helling ervan en de daaropvolgende scheiding produceren de beweging van myosine. Dit proces is cyclisch en afhankelijk van ATP.
- Conforme veranderingen: de hydrolyse van een ATP-molecuul is gekoppeld aan elke stap van een myosinemolecuul, via niveaus van amplificatie en transmissie. Dit omvat grote conformatieveranderingen van myosine..
Het eerste niveau van amplificatie wordt geproduceerd door het verlies van de gamma-fosfaatgroep van ATP, wat een reorganisatie van de structurele elementen in de ATP-bindingsplaats mogelijk maakt. Deze reorganisatie wordt gecoördineerd met structurele veranderingen in de actine-bindende site..
Het tweede niveau van amplificatie omvat de communicatie van de conformatieverandering in de actieve site naar structurele componenten van de carboxylterminal..
- Directionaliteit: Myosinen bleken polariteit of omgekeerde directionaliteit te hebben naar het (+) uiteinde van het actinefilament. Deze conclusie komt uit de experimenten met actine-gloeidraden met behulp van een fluorescentielichtmicroscoop..
Kenmerken
Myosine neemt, samen met actine, deel aan spiercontractie, celadhesie, cytokinese, verstijving van de corticale membranen en de verplaatsing van sommige blaasjes, naast andere functies..
Defecten in myosine kunnen pathologische aandoeningen veroorzaken. Defecten in myosine I en V zijn bijvoorbeeld gerelateerd aan respectievelijk myosine-myopathieën en pigmentatiestoornissen (Griscelli-syndroom). Terwijl stoornissen in myosine VI-isovormen gehoorverlies veroorzaken.
Spiercontractie
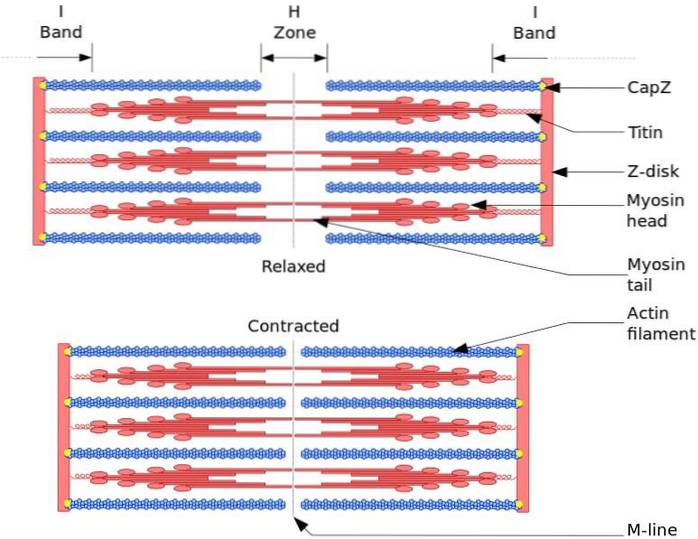
De functionele en structurele eenheid van skeletspieren is de sarcomeer. Tijdens spiercontractie bereikt de lengte van de sarcomeer 30% van zijn oorspronkelijke lengte.
Sarcomeren bestaan uit dikke myosinefilamenten en dunne actinefilamenten die op een complexe manier zijn georganiseerd. Over het algemeen bevinden de myosinekoppen zich aan de distale uiteinden van het filament en hun staarten naar het midden van de sarcomeer, en de organisatie is bipolair.
Om spiercontractie te laten optreden, moeten de myosinekoppen aan de tegenoverliggende uiteinden naar de Z-schijf of het (+) uiteinde van het filament bewegen. Omdat de organisatie van de dikke filamenten bipolair is, vindt het glijden van de dunne filamenten op de dikke filamenten plaats, aangedreven door ATP.
De verplaatsingskracht treedt op omdat honderden myosinekoppen, van een dik filament, in wisselwerking staan met een dun filament.
Cytokinese
Tijdens mitose, wanneer microtubuli aan de spilpolen scheiden, vormen actine en myosine II een samentrekkende ring aan de evenaar van de cel. Deze ring trekt samen, verkleint zijn diameter en verdeelt de cel in twee delen..
Verstijving van corticale membranen
In mutante cellen die myosine II missen, vervormt het plasmamembraan gemakkelijk wanneer een externe kracht wordt uitgeoefend. Dit gebeurt omdat myosine II aggregatiekracht levert aan plasmamembraaneiwitten..
Celadhesie
In epitheelweefsel bevinden de contractiele bundels actine en myosine II zich in de buurt van het plasmamembraan en vormen een cirkelvormige gordel die het binnenste celoppervlak omgeeft. Deze cirkelvormige gordel bepaalt de vorm van de cel en houdt de binding tussen cellen in stand..
Het contact tussen cellen vindt plaats door de vereniging van de cirkelvormige gordel met de cellulaire adhesiemoleculen, door middel van unie-eiwitten.
Verplaatsing van sommige blaasjes
Experimenteel bewijs toont aan dat myosine V membraantransport uitvoert van het Golgi-apparaat naar de periferie van de cel. Enkele bewijzen zijn:
- In zenuwweefselcellen werd door immunofluorescentie van astrocyten gevonden dat myosine V zich naast de Golgi bevindt..
- In gist verstoren mutaties in het myosine V-gen de eiwitsecretie en bijgevolg hoopt het eiwit zich op in het cytosol.
- De myosine I-isovormen zijn verantwoordelijk voor het transport van vacuolen naar het celmembraan. Met behulp van specifieke antilichamen tegen myosine I-isovormen werd ontdekt dat deze isovormen zich in verschillende delen van de cel bevinden..
Wanneer bijvoorbeeld een levende amoebe wordt gelabeld met een antilichaam tegen myosine IC, wordt het transport van de vacuole naar het membraan gestopt. Hierdoor zet de vacuole zich uit en barst de cel open.
Myosine-gerelateerde ziekten
Myosinen en gehoorverlies
Er zijn talloze genen en mutaties die gehoorverlies veroorzaken. Deze ziekte is vaak monogenetisch .
Onconventionele myosinemutaties, met een of twee myosinekoppen, beïnvloeden de werking van het binnenoor. Enkele van de gemuteerde myosine-isovormen zijn myosine IIIA, myosine VIIA en myosine XVA. Onlangs zijn twee mutaties ontdekt in myosine VI.
Mutaties in myosine VI zijn c.897G> T en p.926Q. De eerste mutatie beïnvloedt een regio die in wisselwerking staat met de actieve site, Switch I genaamd. Homozygoot voor de mutatie vertoont het fenotype vroegtijdig en veroorzaakt ernstige effecten.
De tweede mutatie treft een gebied met geladen residuen, in een alfa-helix in de staart van myosine VI. Dit gebied is belangrijk voor proximale motorische dimerisatie en beïnvloedt de stereociliaire functie van myosine VI..
Een andere mutatie is p.Asn207Ser, die een motor produceert die geen kracht kan produceren. Dit komt omdat Asn 207 een aminozuurresidu is van de actieve site, waarvan de functie de binding en hydrolyse van ATP is.
De p.Arg657Trp-mutatie veroorzaakt verlies van de myosine VI-functie. Het Arg-residu is betrokken bij de conformatieveranderingen die hydrolyse koppelen aan de beweging van myosine.
Myosin X en kanker
Myosin X (Myo10) is een onconventioneel myosine dat tot expressie komt in de hersenen, het endotheel en veel epitheel. Myo10 en drie klassen van op actine gebaseerde projecties (filopodia, invadopodia en filopodia-achtige projecties) werken tijdens kankermetastasen.
Invasieve kankercellen hebben grote aantallen filopodia en vertonen hoge niveaus van fascina. Dit eiwit maakt verknopingen tussen actinefilamenten. Om aan de primaire tumor te ontsnappen, worden invadopodia gevormd, rijk aan proteolytische activiteit, die de omringende extracellulaire matrix verteren..
Zodra de cellen de extracellulaire matrix bereiken, helpen de filopodia-achtige projecties zich te verspreiden en te koloniseren. Hoge niveaus van Myo10 duiden op hoge agressiviteit en uitzaaiingen bij borstkanker.
MyoX-silencing veroorzaakt verlies van metastatisch karakter van cellen, die niet in staat zijn om op actine gebaseerde projecties te vormen. Al deze projecties hebben adhesies op basis van integrine, die worden gedragen door Myo10 in het filopodium..
MyoX is betrokken bij de vorming van het centrosoom. De afwezigheid van MyoX bevordert de vorming van multipolaire spillen. MyoX is ook betrokken bij signalering in kankercellen. MyoX wordt bijvoorbeeld geactiveerd door 3,4,5, -inositoltrifosfaat (PIP3).
Referenties
- Alberts, B., Johnson, A., Lewis, J., et al. 2007. Moleculaire biologie van de cel. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, A., Karfunkel-Doron, D., Sirigu, S., Davido, B., Shohat, M., Frydman, M., Houdusse, A., Kanaan, M., Avraham , K. 2014. Nieuwe myosinemutaties voor erfelijk gehoorverlies onthuld door gerichte genomic capture en massaal parallelle sequencing. European Journal of Human Genetics, 22: 768-775.
- Courson, D.S. en Cheney, R.E. 2015. Myosin-X en ziekte. Experimenteel celonderzoek, 334: 10-15.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Cellulaire en moleculaire biologie. Redactioneel Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexico, Sāo Paulo.
- Schliwa, M. en Woehlke, G. 2003. Moleculaire motoren. Nature, 422: 759-765.
- Oké, R.D. 2003. De moleculaire motor-toolbox voor intracellulair transport. Cell, 112: 467-480.



Niemand heeft nog op dit artikel gereageerd.