
Amfipatische moleculen structuur, kenmerken, voorbeelden
De amfipatische of amfifiele moleculen Het zijn degenen die tegelijkertijd affiniteit of afstoting kunnen voelen voor een bepaald oplosmiddel. Oplosmiddelen worden chemisch geclassificeerd als polair of apolair; hydrofiel of hydrofoob. Dit soort moleculen kunnen dus water "liefhebben", net zoals ze het ook kunnen "haten"..
Volgens de vorige definitie is er maar één manier om dit mogelijk te maken: deze moleculen moeten polaire en apolaire gebieden binnen hun structuur hebben; Ofwel zijn ze min of meer homogeen verdeeld (zoals bijvoorbeeld het geval is bij eiwitten), ofwel zijn ze heterogeen gelokaliseerd (in het geval van oppervlakteactieve stoffen)

Oppervlakteactieve stoffen, ook wel detergentia genoemd, zijn misschien wel de bekendste amfipatische moleculen sinds mensenheugenis. Sinds de mens gefascineerd was door de vreemde fysionomie van een luchtbel, bezorgd over de bereiding van zeep en schoonmaakproducten, is hij keer op keer het fenomeen van oppervlaktespanning tegengekomen..
Het observeren van een bel is hetzelfde als het zien van een 'val' waarvan de wanden, gevormd door de uitlijning van amfipatische moleculen, de gasvormige inhoud van de lucht vasthouden. De bolvormen zijn het meest wiskundig en geometrisch stabiel, aangezien ze de oppervlaktespanning van het lucht-watergrensvlak tot een minimum beperken..
Dat gezegd hebbende, zijn twee andere kenmerken van amfipatische moleculen besproken: ze hebben de neiging om te associëren of zichzelf te assembleren, en sommige lagere oppervlaktespanningen in vloeistoffen (die welke dat kunnen, worden oppervlakteactieve stoffen genoemd).
Als resultaat van de sterke neiging tot associatie, openen deze moleculen een gebied van morfologische (en zelfs architectonische) studie van hun nano-aggregaten en de supramoleculen waaruit ze bestaan; met als doel verbindingen te ontwerpen die kunnen worden gefunctionaliseerd en op onmetelijke manieren kunnen interageren met cellen en hun biochemische matrices.
Artikel index
- 1 Structuur
- 1.1 Intermoleculaire interacties
- 1.2 Diversen
- 2 Kenmerken van amfipatische moleculen
- 2.1 Vereniging
- 2.2 Fysiek
- 3 voorbeelden
- 4 Toepassingen
- 4.1 Celmembranen
- 4.2 Dispergeermiddelen
- 4.3 Emulgatoren
- 4.4 Wasmiddelen
- 4.5 Antioxidanten
- 5 referenties
Structuur
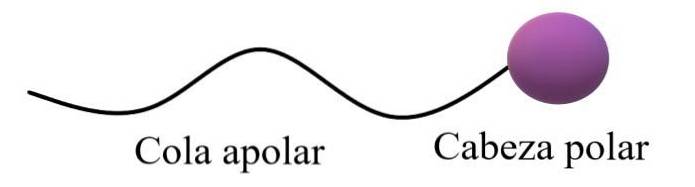
Amfifiele of amfipatische moleculen zouden een polair gebied en een apolair gebied hebben. Het apolaire gebied bestaat gewoonlijk uit een verzadigde of onverzadigde koolstofketen (met dubbele of drievoudige bindingen), die wordt weergegeven als een "apolaire staart"; vergezeld van een "polaire kop", waarin de meest elektronegatieve atomen verblijven.
De algemene structuur bovenaan illustreert de opmerkingen in de vorige paragraaf. De polaire kop (paarse bol) kan functionele groepen zijn of aromatische ringen met permanente dipoolmomenten, en zijn ook in staat om waterstofbruggen te vormen. Daarom moet daar het hoogste zuurstof- en stikstofgehalte zijn.
In deze polaire kop kunnen er ook ionische, negatieve of positieve ladingen zijn (of beide tegelijk). Dit gebied vertoont een hoge affiniteit voor water en andere polaire oplosmiddelen..
Aan de andere kant werkt de apolaire staart, gezien zijn overheersende C-H-bindingen, samen via Londense verstrooiingskrachten. Dit gebied is verantwoordelijk voor het feit dat amfipatische moleculen ook affiniteit vertonen voor vetten en apolaire moleculen in de lucht (Ntwee, COtwee, Ar, enz.).
In sommige scheikunde teksten wordt het model voor de bovenstructuur vergeleken met de vorm van een lolly.
Intermoleculaire interacties
Wanneer een amfipatisch molecuul in contact komt met een polair oplosmiddel, bijvoorbeeld water, oefenen zijn regio's verschillende effecten uit op de oplosmiddelmoleculen..
Om te beginnen proberen de watermoleculen de polaire kop te solvateren of te hydrateren, waarbij ze wegblijven van de apolaire staart. In dit proces ontstaat moleculaire wanorde.
Ondertussen hebben de watermoleculen rond de apolaire staart de neiging om zichzelf te ordenen alsof het kleine kristallen zijn, waardoor ze afstoting tot een minimum kunnen beperken. In dit proces wordt een moleculaire orde gecreëerd.
Tussen stoornissen en orden zal er een punt komen waarop het amfipatische molecuul zal proberen te interageren met een ander, wat zal resulteren in een veel stabieler proces..
Miscelas
Beiden zullen worden benaderd via hun apolaire staarten of poolkoppen, zodanig dat verwante regio's eerst met elkaar in wisselwerking staan. Dit is hetzelfde als je voorstellen dat twee "paarse lolly's" in de bovenstaande afbeelding naderen door hun zwarte staarten te verstrengelen of door hun twee paarse koppen samen te voegen..
En zo begint een interessant associatieverschijnsel, waarbij verschillende van deze moleculen opeenvolgend worden samengevoegd. Ze worden niet willekeurig met elkaar geassocieerd, maar volgens een reeks structurele parameters, die uiteindelijk de apolaire staarten isoleren in een soort "apolaire kern", terwijl de poolkoppen worden blootgelegd als een polaire schil..
Er wordt dan gezegd dat er een bolvormige miscella is geboren. Tijdens de vorming van de miscela is er echter een voorbereidende fase die bestaat uit een zogenaamde lipidedubbellaag. Deze en andere zijn enkele van de vele macrostructuren die amfifiele moleculen kunnen aannemen.
Kenmerken van amfipatische moleculen
Vereniging

Als de apolaire staarten als zwarte eenheden worden beschouwd en de poolkoppen als paarse eenheden, zal het duidelijk zijn waarom in de bovenste afbeelding de bast van de miscela paars is en de kern zwart. De kern is apolair en de interacties met de water- of oplosmiddelmoleculen zijn nul..
Als, aan de andere kant, het oplosmiddel of medium apolair is, zijn het de polaire koppen die de afstoting ondergaan, en bijgevolg zullen ze zich in het midden van de miscella bevinden; dat wil zeggen, het is omgekeerd (A, onderste afbeelding).
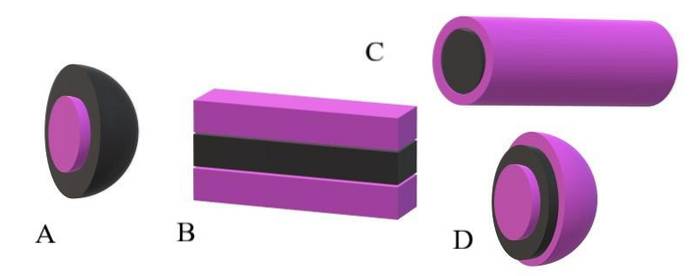
Opgemerkt wordt dat de omgekeerde miscela een zwarte apolaire schaal en een paarse polaire kern heeft. Maar voordat miscela's worden gevormd, wordt gevonden dat de amfifiele moleculen individueel de volgorde van de oplosmiddelmoleculen veranderen. Verhoogde concentratie, ze beginnen zich te associëren in een structuur van een of twee lagen (B).
Van B beginnen de laminae te buigen om D, een blaasje, te vormen. Een andere mogelijkheid, afhankelijk van de vorm van de apolaire staart met betrekking tot zijn polaire kop, is dat ze associëren om aanleiding te geven tot een cilindrische miscella (C).
Nanoaggregaten en supramoleculen
Er zijn daarom vijf hoofdstructuren die een fundamenteel kenmerk van deze moleculen onthullen: hun sterke neiging om te associëren en zichzelf te assembleren tot supramoleculen, die aggregeren om nanoaggregaten te vormen..
Amfifiele moleculen worden dus niet alleen gevonden, maar in samenhang..
Fysiek
Amfipatische moleculen kunnen neutraal of ionisch geladen zijn. Degenen met een negatieve lading hebben een zuurstofatoom met een negatieve formele lading in hun polaire kop. Sommige van deze zuurstofatomen zijn afkomstig van functionele groepen zoals: -COO-, -SW4-, -SW3- of -PO4-.
Wat betreft positieve ladingen, ze zijn meestal afkomstig van amines, RNH3+.
De aanwezigheid of afwezigheid van deze ladingen verandert niets aan het feit dat deze moleculen in het algemeen kristallijne vaste stoffen vormen; of, als ze relatief licht zijn, worden ze als oliën aangetroffen.
Voorbeelden
Enkele voorbeelden van amfipatische of amfifiele moleculen zullen hieronder worden genoemd:
-Phofolipiden: fosfatidylethanolamine, sfingomyeline, fosfatidylserine, fosfatidylcholine.
-Cholesterol.
-Glycolipiden.
-Natriumlaurylsulfaat.
-Eiwitten (ze zijn amfifiel, maar geen oppervlakteactieve stoffen).
-Fenolische vetten: cardanol, cardoles en anacardiale zuren.
-Cetyltrimethylammoniumbromide.
-Vetzuren: palmitinezuur, linolzuur, oliezuur, laurinezuur, stearinezuur.
-Alcoholen met lange keten: 1-dodecanol en andere.
-Amfifiele polymeren: zoals geëthoxyleerde fenolharsen.
Toepassingen
Celmembranen
Een van de belangrijkste consequenties van het associatievermogen van deze moleculen is dat ze een soort wand bouwen: de lipidedubbellaag (B).
Deze dubbellaag strekt zich uit om het binnenkomen en verlaten van verbindingen in cellen te beschermen en te reguleren. Het is dynamisch, omdat zijn apolaire staarten roteren, waardoor amfipatische moleculen kunnen bewegen..
Evenzo, wanneer dit membraan aan twee uiteinden is bevestigd, om het verticaal te hebben, wordt het gebruikt om de permeabiliteit te meten; en hiermee worden waardevolle gegevens verkregen voor het ontwerp van biologische materialen en synthetische membranen uit de synthese van nieuwe amfipatische moleculen met verschillende structurele parameters..
Dispergeermiddelen
In de olie-industrie worden deze moleculen en de polymeren die daaruit worden gesynthetiseerd, gebruikt om asfaltenen te dispergeren. De focus van deze toepassing berust op de hypothese dat asfaltenen bestaan uit een colloïdale vaste stof, met een sterke neiging om uit te vlokken en te sedimenteren als een bruinzwarte vaste stof die ernstige economische problemen veroorzaakt..
Amfipatische moleculen helpen asfaltenen langer verspreid te houden in het licht van fysisch-chemische veranderingen in de ruwe olie..
Emulgatoren
Deze moleculen helpen om twee vloeistoffen te mengen die onder normale omstandigheden niet mengbaar zijn. In ijsjes helpen ze bijvoorbeeld water en lucht samen met vet deel uit te maken van dezelfde vaste stof. Een van de meest gebruikte emulgatoren voor dit doel zijn die welke zijn afgeleid van eetbare vetzuren.
Wasmiddelen
Het amfifiele karakter van deze moleculen wordt gebruikt om vetten of apolaire onzuiverheden op te vangen, die later tegelijkertijd worden afgevoerd door een polair oplosmiddel, zoals water..
Net als het voorbeeld van bellen waarin lucht werd opgesloten, houden wasmiddelen vet vast in hun micellen, die, met een polair omhulsel, efficiënt samenwerken met water om vuil te verwijderen..
Antioxidanten
De polaire koppen zijn van vitaal belang omdat ze de vele toepassingen bepalen die deze moleculen in het lichaam kunnen hebben.
Als ze bijvoorbeeld een reeks aromatische ringen hebben (inclusief derivaten van een fenolische ring) en polaire ringen die vrije radicalen kunnen neutraliseren, dan zullen er amfifiele antioxidanten zijn; en als ze ook geen toxische effecten hebben, komen er nieuwe antioxidanten op de markt.
Referenties
- Alberts B, Johnson A, Lewis J, et al. (2002). Moleculaire biologie van de cel. 4e editie. New York: Garland Science; De lipide dubbelgelaagde. Hersteld van: ncbi.nlm.nih.gov
- Jianhua Zhang. (2014). Amfifiele moleculen. Springer-Verlag Berlin Heidelberg, E. Droli, L. Giorno (red.), Encyclopedia of Membranes, DOI 10.1007 / 978-3-642-40872-4_1789-1.
- Zei Joseph. (2019). Definitie van amfipatische moleculen. Studie. Hersteld van: study.com
- Lehninger, A. L. (1975). Biochemie. (2e editie). Worth Publishers, inc.
- Mathews, C. K., van Holde, K. E. en Ahern, K. G. (2002). Biochemie. (3e editie). Pearson Addison Weshley.
- Helmenstine, Anne Marie, Ph.D. (31 maart 2019). Wat is een oppervlakteactieve stof? Hersteld van: thoughtco.com
- Domenico Lombardo, Mikhail A.Kiselev, Salvatore Magazù en Pietro Calandra (2015). Zelfassemblage van Amphiphiles: basisconcepten en toekomstperspectieven van supramoleculaire benaderingen. Vooruitgang in Condensed Matter Physics, vol. 2015, artikel-ID 151683, 22 pagina's, 2015. doi.org/10.1155/2015/151683.
- Anankanbil S., Pérez B., Fernandes I., Magdalena K. Widzisz, Wang Z., Mateus N. & Guo Z. (2018). Een nieuwe groep van synthetische fenolhoudende amfifiele moleculen voor multifunctionele toepassingen: fysisch-chemische karakterisering en celtoxiciteitsonderzoek. Wetenschappelijke rapporten volume 8, artikelnummer: 832.



Niemand heeft nog op dit artikel gereageerd.