
Dipoolmoment hoe het wordt berekend en voorbeelden
De dipool moment is een chemische eigenschap die aangeeft hoe heterogeen elektrische ladingen in een molecuul worden verdeeld. Het wordt uitgedrukt in Debye-eenheden, 3,33 · 10-30 C · m, en in het algemeen variëren de waarden van 0 tot 11 D.
Zeer polaire verbindingen hebben de neiging om grote dipoolmomenten te hebben; terwijl de apolaire momenten, kleine dipoolmomenten. Hoe meer gepolariseerd de elektrische ladingen in een molecuul zijn, hoe groter het dipoolmoment; dat wil zeggen, er moet een gebied zijn dat rijk is aan elektronen, δ-, en een ander gebied dat arm is aan elektronen, δ+.

Het dipoolmoment, μ, is een vectorgrootte, dus wordt het beïnvloed door de hoeken van de bindingen en, in het algemeen, door de moleculaire structuur.
Als het molecuul lineair is, kan het worden vergeleken met een tweekleurige gum. Het negatieve uiteinde δ-, zou overeenkomen met de kleur rood; terwijl het positieve, δ +, de blauwe kleur zou zijn. Naarmate de grootte van de negatieve ladingen op de δ-pool toeneemt, en de afstand die deze scheidt van δ +, neemt het dipoolmoment toe.
Chemisch gezien betekent dit dat hoe groter het verschil in elektronegativiteit tussen twee atomen, en hoe langer de afstand die hen scheidt, hoe groter het dipoolmoment tussen hen..
Artikel index
- 1 Hoe wordt het dipoolmoment berekend?
- 2 voorbeelden
- 2.1 Water
- 2.2 Methanol
- 2.3 Ammoniak
- 2.4 Ethanol
- 2.5 Kooldioxide
- 2.6 Methaan
- 3 referenties
Hoe bereken je het dipoolmoment?
Het wordt beschouwd als een covalente binding tussen twee atomen, A en B:
A-B
De afstand tussen de positieve en negatieve deelladingen wordt al bepaald door de lengte van hun binding:
NAARδ+-Bδ-
Omdat protonen en elektronen dezelfde grootte van elektrische lading hebben, maar met tegengestelde tekens, 1,6 · 10-19C, hiermee wordt rekening gehouden bij het evalueren van het dipoolmoment tussen A en B met behulp van de volgende vergelijking:
μ = δd
Waar μ het dipoolmoment is, δ de lading is van het elektron zonder het minteken, en d de lengte van de schakel uitgedrukt in meters. Als je dat bijvoorbeeld aanneemt d heeft een waarde van 2 Å (1 10-10m) het dipoolmoment, μA-B zal zijn:
μA-B = (1,6 10-19C) · (2 · 10-10m)
= 3,210-29Cm
Maar aangezien deze waarde erg klein is, wordt de Debye-eenheid gebruikt:
μ = (3210-29C · m) · (1 D / 3.33 · 10-30 Cm)
= 9,60 D.
Deze waarde van μA-B zou kunnen veronderstellen dat de binding A-B meer ionisch dan covalent is.
Voorbeelden
Water
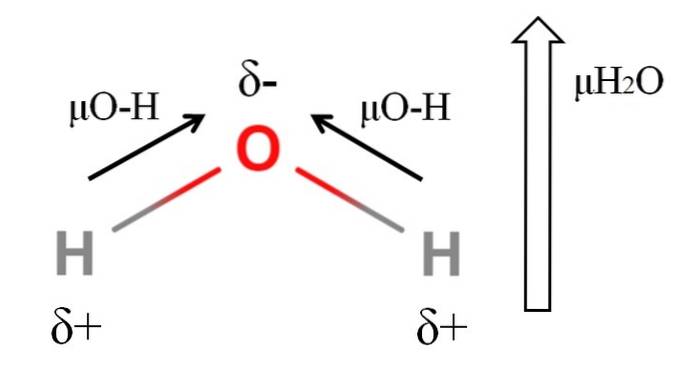
Om het dipoolmoment van een molecuul te berekenen, moeten alle dipoolmomenten van hun respectievelijke bindingen vectorieel worden opgeteld, rekening houdend met de bindingshoeken en een beetje trigonometrie. Dit in het begin.
Water heeft een van de grootste dipoolmomenten die kunnen worden verwacht voor een covalente verbinding. In de bovenste afbeelding hebben we dat waterstofatomen positieve partiële ladingen hebben, δ +, terwijl zuurstof een negatieve partiële lading heeft, δ-. De O-H-binding is behoorlijk polair (1.5D), en er zijn er twee in een H-molecuultweeOF.
Meestal wordt een vector getekend die is gericht van het minst elektronegatieve atoom (H) naar het meest elektronegatieve atoom (O). Hoewel ze niet worden getekend, bevinden zich op het zuurstofatoom twee paar niet-gedeelde elektronen, die het negatieve gebied verder "concentreren"..
Vanwege de hoekige geometrie van de HtweeOf, de dipoolmomenten tellen op in de richting van het zuurstofatoom. Merk op dat de som van de twee μO-H 3D (1,5 + 1,5) zou geven; maar zo is het niet. Het dipoolmoment van water heeft een experimentele waarde van 1.85D. Het effect van de bijna 105 ° hoek tussen de H-O-H-bindingen wordt hier weergegeven..
Methanol
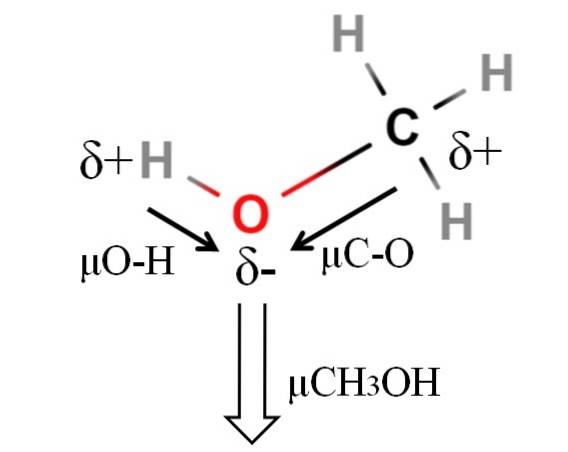
Het dipoolmoment van methanol is 1,69D. Het is minder dan dat van water. Daarom hebben de atoommassa's niet veel invloed op het dipoolmoment; maar hun atoomstralen zijn dat wel. In het geval van methanol kunnen we niet bevestigen dat de H-O-binding een μ gelijk aan 1,5D heeft; aangezien de moleculaire omgevingen verschillen in CH3OH en HtweeOF.
Daarom zou de lengte van de H-O-binding in methanol moeten worden gemeten om μO-H te berekenen. Wat wel kan worden gezegd is dat μO-H groter is dan μC-O, aangezien het elektronegativiteitsverschil tussen koolstof en zuurstof kleiner is dan tussen waterstof en zuurstof..
Methanol wordt vermeld als een van de meest polaire oplosmiddelen die samen met water en ammoniak kunnen worden gevonden..
Ammoniak
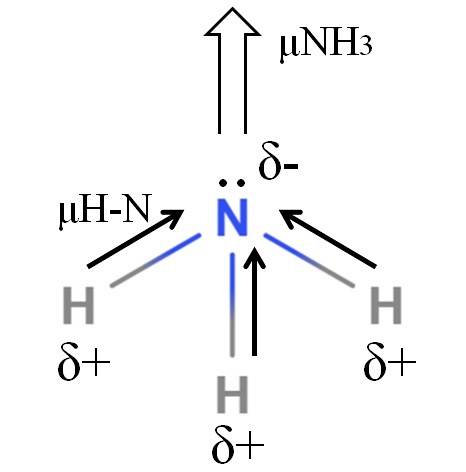
De H-N-bindingen zijn behoorlijk polair, dus stikstof trekt, vanwege zijn hogere elektronegativiteit, elektronen naar zichzelf toe (bovenste afbeelding). Daarnaast hebben we daarop een ongedeeld paar elektronen, die hun negatieve ladingen bijdragen aan het δ-gebied. Daarom overheersen elektrische ladingen op het stikstofatoom van ammoniak..
Ammoniak heeft een dipoolmoment van 1,42D, minder dan dat van methanol. Als zowel ammoniak als methanol in tocht zouden kunnen worden omgezet, zou men zien dat de methanolonttrekking meer gedefinieerde polen heeft in vergelijking met de ammoniakonttrekking.
Ethanol
In het geval van ethanol, CH3CHtweeOH, het dipoolmoment ligt heel dicht bij dat van methanol, maar het heeft de neiging om lagere waarden te hebben. Aangezien er meer koolstofatomen zijn die het δ + -gebied vormen, begint het zuurstofatoom dat δ- vertegenwoordigt een beetje van zijn "relatieve negatieve intensiteit" te verliezen..
Kooldioxide
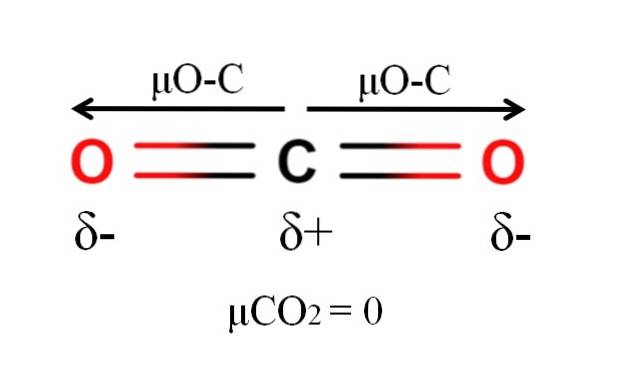
Koolstofdioxide heeft twee polaire bindingen, C = O, met hun respectievelijke dipoolmomenten μO-C. Zoals te zien is in de afbeelding hierboven, is de lineaire geometrie van COtwee zorgt ervoor dat de twee μO-C elkaar vectorisch opheffen, zelfs als koolstof een positieve gedeeltelijke lading heeft en zuurstofatomen een negatieve gedeeltelijke lading.
Daarom is kooldioxide een apolair molecuul, aangezien μCOtwee heeft een waarde van 0D.
Methaan
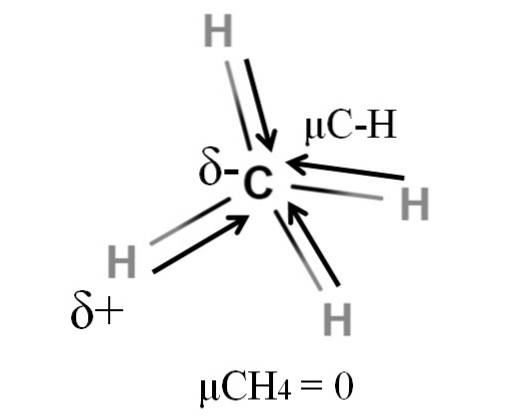
Zowel methaan als kooldioxide hebben iets gemeen: het zijn zeer symmetrische moleculen. Over het algemeen geldt dat hoe symmetrischer een molecuul is, hoe kleiner het dipoolmoment..
Als we het CH-molecuul zien4, de C-H-bindingen zijn polair en de elektronen zijn gericht naar het koolstofatoom omdat het iets elektronegatiever is. Men zou kunnen denken dat koolstof een zeer negatieve δ-regio zou moeten zijn; als een gum met zijn dieprode centrum en blauwachtige uiteinden.
Door de CH4 in de helft zouden we twee H-C-H-helften krijgen, een aan de linkerkant en de andere aan de rechterkant, vergelijkbaar met het H-molecuultweeO. Dus het dipoolmoment als gevolg van het optellen van deze twee μC-H zou teniet worden gedaan met dat van de andere helft. En daarom μCH4 heeft een waarde van 0D.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Walter J. Moore. (1963). Fysische chemie. In chemische kinetiek. Vierde editie, Longmans.
- Ira N. Levine. (2009). Principes van fysicochemie. Zesde editie, blz. 479-540. Mc Graw Hill.
- Helmenstine, Anne Marie, Ph.D. (29 januari 2020). Dipoolmomentdefinitie. Hersteld van: thoughtco.com
- Blaber Mike. (29 september 2019). Dipool-momenten. Chemie LibreTexts. Hersteld van: chem.libretexts.org
- LaRita Williams. (2020). Dipoolmoment: definitie, vergelijking en voorbeelden. Studie. Hersteld van: study.com
- Wikipedia. (2020). Bond dipool moment. Hersteld van: en.wikipedia.org


Niemand heeft nog op dit artikel gereageerd.