
Formules, eigenschappen, toepassingen en risico's van aluminiumnitraat
De aluminiumnitraat Het is het aluminiumzout van salpeterzuur. Aluminiumnitraat nonahydraat verschijnt bij kamertemperatuur als een kleurloze vaste stof met de geur van salpeterzuur..
Ze zijn niet brandbaar, maar ze kunnen de verbranding van brandbare materialen versnellen. Als het om grote hoeveelheden aluminiumnitraat gaat of als brandbaar materiaal fijn verdeeld is, kan er een explosie optreden..

Langdurige blootstelling aan vuur of hitte kan tot een explosie leiden. Bij aanraking met vuur produceren ze stikstofoxiden. Het wordt onder meer gebruikt voor het raffineren van aardolie en het verven en looien van leer..
Het is een wit, in water oplosbaar zout dat meestal voorkomt in zijn kristallijne nonahydraatvorm (aluminiumnitraat nonahydraat)..
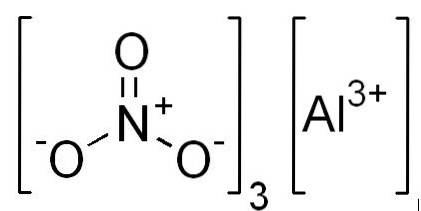
Artikel index
- 1 Formules
- 2 Structuur
- 2.1 In 2D
- 2.2 In 3D
- 3 Fysische en chemische eigenschappen
- 3.1 Reactiviteitswaarschuwingen
- 3.2 Reacties met lucht en water
- 3.3 Ontvlambaarheid
- 3.4 Reactiviteit
- 3.5 Toxiciteit
- 4 toepassingen
- 5 Klinische effecten
- 6 Veiligheid en risico's
- 6.1 GHS-gevarenklassen
- 6.2 Codes voor veiligheidsaanbevelingen
- 7 referenties
Formules
- Aluminiumnitraat: Al (NO33
- Aluminiumnitraat nonahydraat: Al (NO33 9HtweeOF
- CAS: 13473-90-0 aluminiumnitraat (watervrij)
- CAS: 14797-65-0 aluminiumnitraat (nonahydraat)
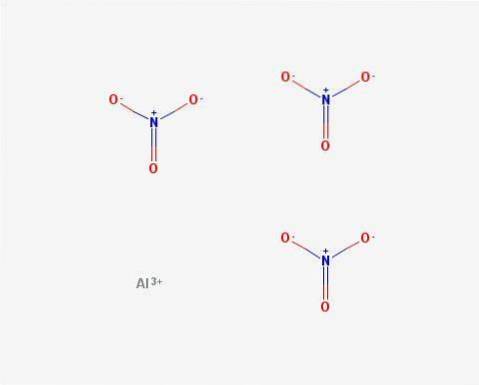
Structuur
In 2D
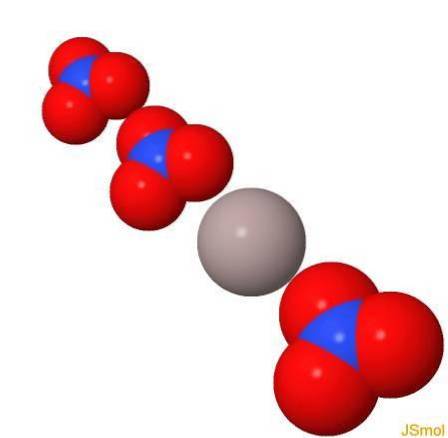
In 3d
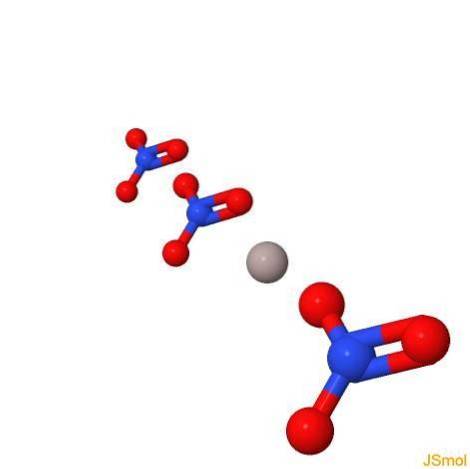
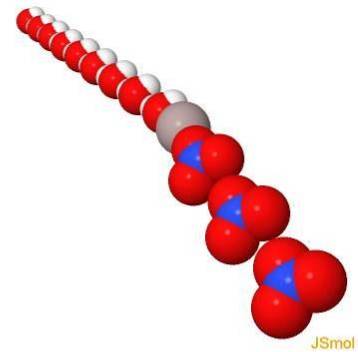
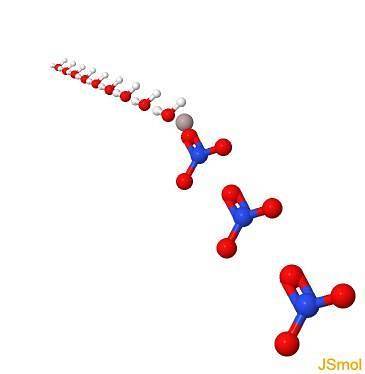
Fysische en chemische eigenschappen
- Aluminiumnitraat behoort tot de reactieve groep van anorganische nitraat- en nitrietverbindingen.
- Het nitraation is een polyatomisch ion met de molecuulformule NO3 - en is de geconjugeerde base van salpeterzuur.
- Bijna alle anorganische nitraatzouten zijn oplosbaar in water bij standaard temperatuur en druk..
- Nitraatverbindingen hebben een breed scala aan toepassingen op basis van hun activiteit als oxidatiemiddel, de aanwezigheid van vrij beschikbare stikstof of hun hoge oplosbaarheid..
Reactiviteitswaarschuwingen
Aluminiumnitraat is een sterk oxidatiemiddel.
Reacties met lucht en water
Aluminiumnitraat is vervloeiend (het heeft de eigenschap om vocht uit de lucht te absorberen om een waterige oplossing te vormen). Het is oplosbaar in water. De waterige oplossingen zijn zuur.
Ontvlambaarheid
Nitraten en nitrieten zijn explosieve verbindingen. Sommige van deze stoffen kunnen bij verhitting of bij brand explosief ontleden. Ze kunnen exploderen door hitte of vervuiling. Containers kunnen bij verhitting ontploffen.
Speciale gevaren van verbrandingsproducten: giftige stikstofoxiden kunnen worden gevormd bij brand met aluminiumnitraat.
Reactiviteit
Nitraten en nitrieten kunnen als extreem krachtige oxidatiemiddelen werken en mengsels met reductiemiddelen of gereduceerde materialen zoals organische stoffen kunnen explosief zijn. Reageer met zuren om giftig stikstofdioxide te vormen.
In het algemeen zijn nitraat- en nitrietzouten met redoxactieve kationen (overgangsmetalen en de metalen van groep 3a, 4a en 5a van het periodiek systeem, evenals het ammoniumkation [NH4] +) reactiever met organische materialen en middelen. Versnellingsbakken in omgevingsomstandigheden.
Aluminiumnitraat is een oxidatiemiddel. Mengsels met alkylesters kunnen exploderen. Mengsels met fosfor, tin (II) chloride of andere reductiemiddelen kunnen explosief reageren.
Toxiciteit
Mensen zijn onderhevig aan nitraat- en nitrietvergiftiging, waarbij kinderen bijzonder kwetsbaar zijn voor methemoglobinemie.
Inname van grote doses aluminiumnitraat veroorzaakt maagirritatie, misselijkheid, braken en diarree. Contact met stof irriteert de ogen en de huid.
Toepassingen
Nitraten en nitrieten worden veel gebruikt (en in zeer grote hoeveelheden) als meststof in de landbouw vanwege hun bereidheid om stikstof af te breken en af te geven voor plantengroei en vanwege hun oplosbaarheid, waardoor nitraationen kunnen worden opgenomen door de wortels van de plant.
Nitraatverbindingen worden ook veel gebruikt als industriële grondstof wanneer een oxidatiemiddel of een nitraationenbron vereist is..
Aluminiumnitraat wordt gebruikt bij de vervaardiging van chemicaliën voor laboratoria, cosmetica en persoonlijke hygiëne. In de industrie wordt het gebruikt als tussenproduct bij de vervaardiging van andere stoffen.
Het wordt gebruikt bij het looien van leer, in anti-transpiranten, corrosieremmers, bij uraniumextractie, aardolieraffinage en als nitreermiddel..
Aluminiumnitraat nonahydraat en andere gehydrateerde aluminiumnitraten hebben vele toepassingen. Deze zouten worden gebruikt om aluminiumoxide te produceren voor de bereiding van isolerend papier, in verwarmingselementen van kathodestraalbuizen en in de kernlaminaten van transformatoren. Gehydrateerde zouten worden ook gebruikt voor de extractie van actinidische elementen.
Klinische effecten
Aluminium is alomtegenwoordig, het is het meest voorkomende metaal in de aardkorst. De meeste menselijke blootstelling is afkomstig van voedsel. Het is aanwezig in sommige farmaceutische producten. In de industrie wordt het veel gebruikt.
Aluminium remt de hermodellering van het bot en veroorzaakt osteomalacie. Aangenomen wordt dat het de erytropoëse remt en bloedarmoede veroorzaakt.
Acute vergiftiging is zeldzaam. Oplosbare vormen van aluminium hebben een groter potentieel voor toxiciteit dan onoplosbare vormen, vanwege hun grotere absorptie..
Patiënten met nierfalen zijn vatbaar voor aluminiumtoxiciteit, hetzij door aluminium in het dialysaat, hetzij door andere exogene bronnen, met name fosfaatbinders en aluminiumbevattende antacida..
Chronische blootstelling aan aluminiumstof kan dyspnoe, hoest, longfibrose, pneumothorax, pneumoconiose, encefalopathie, zwakte, coördinatiestoornissen en epileptische aanvallen veroorzaken..
Aluminiumzouten kunnen irritatie van de ogen en slijmvliezen, conjunctivitis, dermatose en eczeem veroorzaken..
Hoewel aluminium en zijn verbindingen weinig bewijs van kankerverwekkendheid bij mensen hebben getoond, is blootstelling aan andere stoffen die betrokken zijn bij de productie van aluminium in verband gebracht met kankerverwekkendheid..
Veiligheid en risico's
Gevarenaanduidingen van het wereldwijd geharmoniseerde systeem voor de classificatie en etikettering van chemicaliën (GHS).
Het Globally Harmonized System of Classification and Labelling of Chemicals (GHS) is een internationaal overeengekomen systeem, gecreëerd door de Verenigde Naties en ontworpen om de verschillende classificatie- en etiketteringsnormen die in verschillende landen worden gebruikt te vervangen door wereldwijd consistente criteria te gebruiken..
De gevarenklassen (en hun overeenkomstige hoofdstuk van het GHS), de classificatie- en etiketteringsnormen en de aanbevelingen voor aluminiumnitraat en voor aluminiumnitraat nonahydraat zijn als volgt (European Chemicals Agency, 2017; United Nations, 2015; PubChem, 2017):
GHS-gevarenklassen
H272: Kan brand bevorderen; Oxidatiemiddel [Waarschuwing Oxiderende vloeistoffen; Oxiderende vaste stoffen - Categorie 3] (PubChem, 2017).
H301: Giftig bij inslikken [gevaar voor acute toxiciteit, oraal - Categorie 3] (PubChem, 2017).
H315: Veroorzaakt huidirritatie [Waarschuwing Huidcorrosie / -irritatie - Categorie 2] (PubChem, 2017).
H318: Veroorzaakt ernstig oogletsel [Gevaar Ernstig oogletsel / oogirritatie - Categorie 1] (PubChem, 2017).
H319: Veroorzaakt ernstige oogirritatie [Waarschuwing Ernstig oogletsel / oogirritatie - Categorie 2A] (PubChem, 2017).
Codes voor voorzorgsmaatregelen
P210, P220, P221, P264, P270, P280, P301 + P310, P302 + P352, P305 + P351 + P338, P310, P321, P330, P332 + P313, P337 + P313, P362, P370 + P378, P405 en P501 (PubChem, 2017).





Referenties
- ChemIDplus (2017) 3D-structuur van 13473-90-0 - Aluminiumnitraat [afbeelding] Hersteld van: chem.nlm.nih.gov.
- ChemIDplus (2017) 3D-structuur van 7784-27-2 - Aluminiumnitraat nonahydraat [afbeelding] Hersteld van: chem.nlm.nih.gov.
- Daisa, J. (2017) Shell Oil Refinery at Dusk [afbeelding] Hersteld van: flickr.com.
- Edgar181 (2008) Aluminiumnitraat [afbeelding]. Hersteld van: wikipedia.org.
- Europees Agentschap voor chemische stoffen (ECHA). (2016). Aluminiumnitraat. Kort profiel. Opgehaald op 8 februari 2017, via echa.europa.eu.
- Gegevensbank gevaarlijke stoffen (HSDB). TOXNET. (2017). Aluminiumnitraat. Bethesda, MD, EU: National Library of Medicine. Hersteld van: chem.nlm.nih.gov.
- JSmol (2017) Nitraat [afbeelding] Hersteld van: chemapps.stolaf.edu.
- Wikipedia. (2017). Aluminiumnitraat. Opgehaald op 8 februari 2017, van: wikipedia.org.
- Wikipedia. (2017). Aluminiumnitraat nonahydraat. Opgehaald op 8 februari 2017, van: wikipedia.org.



Niemand heeft nog op dit artikel gereageerd.