
Niet-metalen geschiedenis, eigenschappen, groepen, gebruik
De geen metalen Ze zijn een groep elementen die zich aan de rechterkant van het periodiek systeem bevinden, met uitzondering van waterstof dat zich in groep 1 (IA) bevindt, samen met de alkalimetalen. Als je wilt weten wat ze zijn, moet je naar de rechterbovenhoek van het p-blok kijken.
Niet-metalen atomen zijn relatief klein en hun buitenste elektronische schil heeft een groot aantal elektronen. Onder de niet-metalen elementen kunnen vaste stoffen, vloeistoffen en gassen zijn; hoewel de meeste in gasvormige toestand zijn, verrijken verschillende de atmosfeer.
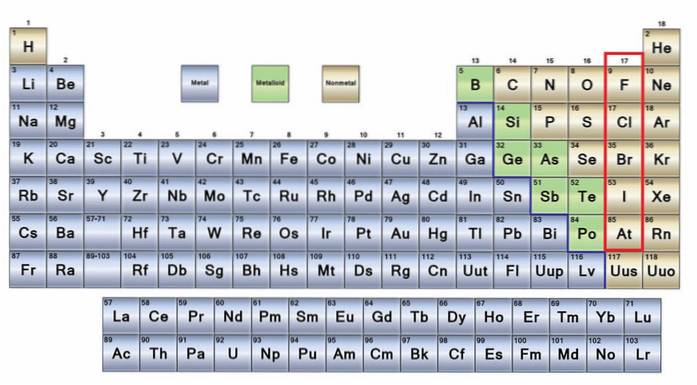
Een groot deel van de niet-metalen is in alle levende wezens aanwezig in de vorm van verbindingen en macromoleculen. Bijvoorbeeld: koolstof, zuurstof en waterstof zijn aanwezig in alle eiwitten, lipiden, koolhydraten en nucleïnezuren.
Fosfor is aanwezig in alle nucleïnezuren en in sommige koolhydraten en lipiden. Zwavel wordt in veel eiwitten aangetroffen. Stikstof maakt deel uit van alle nucleïnezuren en eiwitten.
Aan de andere kant bestaan ondergronds, methaangassen en ruwe olie bijna volledig uit niet-metalen elementen. In feite geven koolwaterstoffen (koolstof en waterstof) een idee van hoe overvloedig niet-metalen zijn, ondanks hun lagere aantal elementen in het periodiek systeem..
Artikel index
- 1 Geschiedenis
- 2 Fysische en chemische eigenschappen
- 2.1 Fysica
- 2.2 Chemie
- 3 groepen niet-metalen en elementen
- 3.1 Groep 1
- 3.2 Groep 14
- 3.3 Groep 15
- 3.4 Groep 16
- 3.5 Groep 17
- 3.6 Groep 18
- 4 toepassingen
- 4.1 Waterstof
- 4.2 Koolstof
- 4.3 Stikstof
- 4.4 Fosfor
- 4.5 Zuurstof
- 4.6 Zwavel
- 4.7 Selenium
- 4.8 Fluor
- 4.9 Chloor
- 4.10 Broom
- 4.11 Jodium
- 4.12 Helium
- 4.13 Neon
- 4.14 Argon
- 4.15 Xenon
- 4.16 Radon
- 5 referenties
Verhaal
Sinds de oudheid (3750 v.Chr.) Gebruikten de Egyptenaren steenkool om het koper in hun mineralen, zoals korvelliet en malachiet, te verminderen..
In 1669 slaagde Hennin Brand erin om fosfor uit de verzamelde urine te isoleren. Henry Cavendish (1776) slaagde erin waterstof te identificeren, hoewel verschillende onderzoekers, waaronder Robert Boyle (1670), waterstof produceerden door een sterk zuur te laten reageren met een metaal..
Carl Scheele produceerde zuurstof door kwikoxide te verhitten met nitraten (1771). Curtois slaagde erin jodium te isoleren, terwijl hij probeerde salpeter te bereiden uit zeewier (1811). Balard en Gmelin geïsoleerd broom (1825).
In 1868 ontdekten Janssen en Lockger onafhankelijk helium door een gele lijn te observeren in de studie van het spectrum van zonlicht dat niet tot een ander element behoorde. Moissan slaagde erin fluoride te isoleren (1886).
In 1894 ontdekten Lord Rayleigh en Ramsey argon door de eigenschappen van stikstof te bestuderen. Ramsay en Travers (1898) isoleerden krypton, neon en xenon uit vloeibaar argon door cryogene destillatie van lucht..
Fysische en chemische eigenschappen

Fysiek
Enkele van de fysische eigenschappen van niet-metalen zijn:
-Ze hebben een lage elektrische geleiding, behalve koolstof in de vorm van grafiet, dat een goede geleider van elektriciteit is..
-Ze kunnen verschijnen onder het fysieke uiterlijk van vaste stoffen, vloeistoffen of gassen.
-Ze hebben een lage thermische geleiding, behalve koolstof in de vorm van diamant, die zich niet gedraagt als een thermische isolator..
-Ze hebben een lage glans, in tegenstelling tot de metaalglans van metalen.
-Niet-metalen vaste stoffen zijn bros, dus ze zijn niet ductiel of kneedbaar.
-Ze hebben een laag smeltpunt en kookpunt.
-Ze kunnen verschillende kristallijne structuren hebben. Zo hebben fosfor, zuurstof en fluor een kubische kristallijne structuur; waterstof, koolstof en stikstof, hexagonaal; en zwavel, chloor, broom en jodium, orthorhombisch.
Chemie
Niet-metalen worden gekenmerkt door een hoge ionisatie-energie en een hoge elektronegativiteitswaarde. Fluor heeft bijvoorbeeld de hoogste elektronegativiteit (3,98) en is het meest reactieve element van de niet-metalen.
Maar verrassend genoeg hebben de edelgassen helium (5,5) en neon (4,84) de hoogste elektronegativiteit. Ze zijn echter chemisch inert omdat de buitenste elektronicaschalen gevuld zijn..
Niet-metalen vormen ionische verbindingen met metalen en covalent met niet-metalen.
Niet-metalen elementen vormen diatomische moleculen, verbonden door covalente bindingen. Ondertussen hebben de atomen van edelgassen de vorm van atomaire eenheden.
Ze vormen zure oxiden die bij reactie met water aanleiding geven tot zuren.
Niet-metalen groepen en elementen
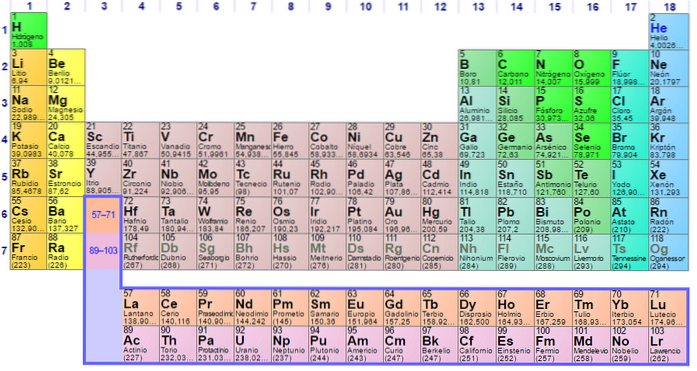
Groep 1
Het bestaat uit waterstof, een kleurloos en reukloos gas, diatomisch. Oxidatietoestand +1. Het heeft een lagere dichtheid dan lucht. In vaste toestand heeft het een hexagonale kristallijne structuur. Waterstof is een slecht reactief element.
Groep 14
Koolstof is het enige niet-metaal in deze groep. Koolstof in de vorm van grafiet is een glanzende vaste stof met een hexagonale kristallijne structuur. Het heeft een hoge elektrische geleidbaarheid. De meest voorkomende oxidatietoestanden zijn +2 en +4.
Groep 15
Stikstof
Kleurloos en reukloos gas. Het is een licht reactief element en iets dichter dan lucht. Meest voorkomende oxidatietoestanden: -3 en +5. Vormt twee atomen moleculen, N.twee.
Bij elkaar passen
Effen, de kleur kan wit, geel of zwart zijn. Beetje reactief. Orthorhombische kristalstructuur. Elektronegativiteit 2.1. Meest voorkomende oxidatietoestanden: -3 en +5.
Groep 16
Zuurstof
Kleurloos of lichtblauw gas, geurloos. Over het algemeen niet reactief. Kubieke kristalstructuur. Het is een isolator en een sterk oxidatiemiddel. Elektronegativiteit 3.5. Oxidatietoestand -2
Zwavel
Briljantgele vaste stof, broos, matig reactief. Orthorhombische kristalstructuur. Vormt covalente bindingen. Elektronegativiteit 2.5. De meest voorkomende oxidatietoestanden: -2, +2, +4 en +6.
Selenium
Effen grijs of roodachtig tot zwart. Grijs selenium vertoont lichtgevoelige elektrische geleidbaarheid. Het is een zachte en broze vaste stof. Elektronegativiteit 2.4. Oxidatietoestanden: -2, +2, +4 en +6.
Groep 17
Fluor
Het is een bleekgeel gas, erg giftig. Het is een zeer reactief element. Het komt voor als twee atomen moleculen, F.twee. In vaste toestand kristalliseert het in kubische vorm. Elektronegativiteit 3.98. Oxidatietoestanden -1.
Chloor
Het is een groen-geel gas. Het presenteert twee atomen moleculen, Cltwee. Het is erg reactief. In vaste toestand is de kristallijne structuur orthorhombisch. Elektronegativiteit 3.0. Oxidatietoestanden: - 1, +1, +3, +5, +7.
Broom
Het is een roodbruine vloeistof. Elektronegativiteit 2.8. Oxidatietoestanden -1, +1, +3, +5 en +7.
Jodium
Het is een zwarte vaste stof die bij sublimatie een violette damp afgeeft. Orthorhombische kristalstructuur. Metaaljodiden zijn ionisch. Elektronegativiteit 2.5. Oxidatietoestanden: -1, +1, +3, +5 en +7.
Astatus
Het is een effen zwart. Op het gezicht gerichte kubische kristalstructuur. Elektronegativiteit 2.2. Het is een zwak oxidatiemiddel.
Groep 18
Helium
Het heeft een hoge thermische geleidbaarheid. Elektronegativiteit 5.5. Het is chemisch inert en niet brandbaar. Lage dichtheid en hoge vloeibaarheid.
Neon
Hoge koelcapaciteit in vloeibare toestand. Elektronegativiteit 4.84. Het is de minst reactieve van de edelgassen.
Argon
Het is dichter dan lucht. Chemisch inert. Elektronegativiteit 3.2.
Krypton
Elektronegativiteit 2,94. Kan reageren met fluor om krypton difluoride (KrFtwee.
Xenon
Het passeert de bloed-hersenbarrière. Het reageert op elektrische stroom door licht te produceren. Elektronegativiteit 2.2. Vormt complexen met fluor, goud en zuurstof.
Radon
Het is een radioactief element. Elektronegativiteit 2.06. Vormt verbindingen met fluor (RnFtwee) en met zuurstof (RnO3.
Toepassingen
Waterstof
Het wordt gebruikt in raketvoortstuwing en als brandstof in automotoren die waterstof gebruiken. Het wordt gebruikt bij de synthese van ammoniak (NH3) en bij de hydrogenering van vetten.
Koolstof

Grafiet wordt gebruikt bij de vervaardiging van potloden en zeer sterke vezels die worden gebruikt bij de vervaardiging van sportartikelen. Diamant wordt gebruikt als een edelsteen van grote waarde en in boorgaten als schuurmiddel. Koolstofdioxide wordt gebruikt bij de productie van koolzuurhoudende dranken.
Stikstof
Het wordt gebruikt bij de productie van ammoniak, salpeterzuur en ureum. Stikstof is een essentieel element voor planten en wordt gebruikt bij de productie van meststoffen.
Bij elkaar passen
Witte fosfor wordt gebruikt als rodenticide, insecticide en in de vuurwerkindustrie. Rode fosfor wordt gebruikt om lucifers te maken. De verbindingen worden ook gebruikt bij de productie van meststoffen.
Zuurstof
Zuurstof wordt gebruikt bij de vervaardiging van staal, kunststoffen en textiel. Het wordt ook gebruikt in raketstuwstoffen, zuurstoftherapie en ademhalingsondersteuning in vliegtuigen, onderzeeërs en ruimtevluchten..
Zwavel
Het wordt gebruikt als grondstof voor de productie van zwavelzuur, buskruit en bij het vulkaniseren van rubbers. Sulfieten worden gebruikt om papier te bleken en in fungicide.
Selenium
Het wordt gebruikt om een scharlakenrode tint aan glas te geven. Het wordt ook gebruikt om de groenachtige tint te neutraliseren die wordt veroorzaakt door vervuiling van het glas met ijzerverbindingen. Het wordt gebruikt in foto-elektrische cellen met toepassing in deuren en liften.
Fluor

Het wordt toegevoegd aan tandpasta's om gaatjes te voorkomen. Waterstoffluoride wordt gebruikt als grondstof voor teflon. Monatomisch fluor wordt gebruikt bij de vervaardiging van halfgeleiders.
Chloor
Het wordt gebruikt in de extractieve metallurgie en bij de chlorering van koolwaterstoffen voor de vervaardiging van verschillende producten zoals PVC. Chloor wordt gebruikt in houtpulp en textielbleekmiddelen. Het wordt ook gebruikt als waterdesinfectiemiddel.
Broom
Het wordt gebruikt bij de bereiding van zilverbromide voor lichtgevoelige lenzen en in fotografische film.Het wordt ook gebruikt bij de vervaardiging van het kalmeringsmiddel natriumbromide en dibromethaan, een antiknokcomponent van benzine.
Jodium
Kaliumjodide (KI) wordt toegevoegd om schildklierstruma te voorkomen. Tinctuur van jodium wordt gebruikt als antisepticum en germicide. Jodium maakt deel uit van de schildklierhormonen.
Helium
Het wordt gebruikt bij het vullen van heteluchtballonnen en gemengd met zuurstof voor ademhaling in diep water. Het wordt gebruikt voor lassen in een inerte atmosfeer, en helpt ook om bij onderzoek zeer lage temperaturen te handhaven.
Neon
In glazen buizen die worden verlicht door de werking van elektriciteit (rode neonlichten).
Argon
Wordt gebruikt om een atmosfeer te creëren bij het lassen en bij het vullen van gloeilampen.
Xenon
Een mengsel van xenon en krypton wordt gebruikt bij de productie van flitsen met hoge intensiteit bij korte fotografische belichtingen.
Radon
Het wordt gebruikt bij de behandeling van kankertumoren door middel van radiotherapie.
Referenties
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. en Ahern, K. G. (2002). Biochemie. Derde editie. Bewerk. Pearson-Addison Wesley
- Helmenstine, Anne Marie, Ph.D. (06 oktober 2019). Wat zijn de eigenschappen van niet-metalen? Hersteld van: thoughtco.com
- Wikipedia. (2019). Niet-metalen. Hersteld van: en.wikipedia.org
- De redactie van Encyclopaedia Britannica. (5 april 2016). Niet-metalen. Encyclopædia Britannica. Hersteld van: britannica.com
- José M. Gavira Vallejo. (2016, 27 januari). Wat zijn de polygene elementen? En de icosagens, de crystallógens, de chalcogens ...? Hersteld van: triplenlace.com


Niemand heeft nog op dit artikel gereageerd.