
Calciumoxalaat (CaC2O4) eigenschappen, structuur, gebruik, risico's
De calciumoxalaat Het is een organische verbinding gevormd door de elementen koolstof (C), zuurstof (O) en calcium (Ca). De chemische formule is CaCtweeOF4. Het wordt over het algemeen aangetroffen in zijn drie gehydrateerde vormen: mono-, di- en trihydraat. Dat wil zeggen, met respectievelijk één, twee of drie moleculen water in zijn kristallijne structuur..
Calciumoxalaat wordt aangetroffen in mineralen, planten, schimmels en andere levende wezens zoals zoogdieren en zelfs bij mensen als gevolg van het metabolisme van sommige eiwitten. Het kan worden gevonden in de urine van mensen en sommige dieren.
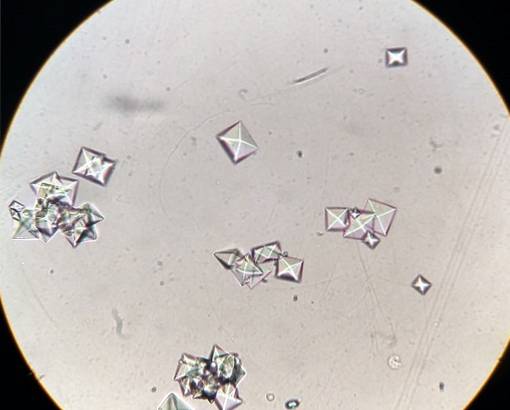
Sommige voedingsmiddelen zoals spinazie, rabarber, soja en chocolade bevatten veel oxalaten, en als gevoelige mensen ze eten, kunnen zich calciumoxalaatstenen in hun nieren vormen..
CaC-stenen kunnen worden voorkomentweeOF4 in de nieren als ze veel vloeistoffen binnenkrijgen, vooral water, voedsel met veel oxalaten vermijden en voedsel dat rijk is aan calcium en magnesium consumeren.
Calciumoxalaat vormt ongewenste kalkaanslag in leidingen en tanks bij processen zoals de productie van pulp en papier, en ook in brouwerijen.
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Soortelijk gewicht
- 3.5 Oplosbaarheid
- 3,6 pH
- 3.7 Chemische eigenschappen
- 4 Aanwezigheid in de natuur
- 4.1 In mineralen
- 4.2 In planten en schimmels
- 5 Aanwezigheid in het menselijk lichaam en zoogdieren
- 5.1 Bij mensen
- 5.2 Factoren die het uiterlijk van stenen in de nieren beïnvloeden
- 5.3 Manieren om de vorming van calciumoxalaatstenen te voorkomen
- 5.4 Bij dieren
- 5.5 Reactie van het lichaam op overmatig oxalaat
- 6 toepassingen
- 6.1 Problemen bij sommige processen
- 7 Risico's
- 8 referenties
Structuur
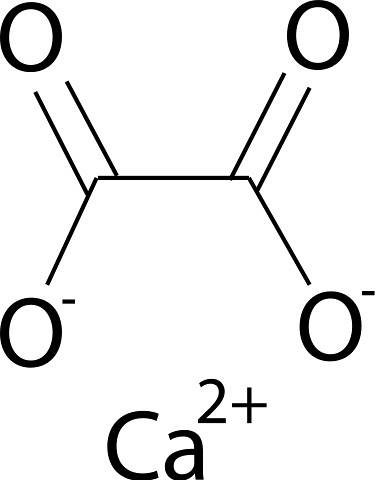
Calciumoxalaat wordt gevormd door het calciumion Catwee+ en het oxalaation CtweeOF4twee-. Het oxalaatanion bestaat uit twee koolstofatomen en vier zuurstofatomen. De negatieve ladingen van het oxalaatanion bevinden zich op de zuurstofatomen.
Nomenclatuur
- Calciumoxalaat
- Oxaalzuur calciumzout
- Ethaandizuur calciumzout
Eigendommen
Fysieke toestand
Kleurloze, witte, gele of bruine kristallijne vaste stof die in drie verschillende gehydrateerde vormen kan zijn.
Molecuulgewicht
128,1 g / mol
Smeltpunt
Calciumoxalaat-monohydraat ontleedt bij 200 ° C.
Specifiek gewicht
Monohydraat CaCtweeOF4 •H.tweeO = 2,22 g / cm3
Dihydraat CaCtweeOF4 •2HtweeO = 1,94 g / cm3
Trihydraat CaCtweeOF4 •3HtweeO = 1,87 g / cm3
Oplosbaarheid
Bijna onoplosbaar in water: 0,00061 g / 100 g water bij 20 ° C. Monohydraat lost op in verdund zuur.
pH
Waterige oplossingen van calciumoxalaat zijn zwak basisch.
Chemische eigenschappen
Calciumoxalaat is het calciumzout van oxaalzuur. Dit is een natuurlijk bijproduct van het metabolisme, dus het is zeer overvloedig aanwezig in het menselijk lichaam en maakt deel uit van veel voedingsmiddelen.
Oxaalzuur en zijn geconjugeerde base, oxalaat, zijn sterk geoxideerde organische verbindingen met een krachtige chelerende activiteit, dat wil zeggen dat ze gemakkelijk kunnen worden gecombineerd met positieve ionen met ladingen van +2 of +3.
De waterige oplossingen zijn zwak basisch omdat het oxalaation de neiging heeft H-protonen op te nemen.+ uit water, dat OH-ionen afgeeft-. Na het nemen van twee protonen H+ het oxalaation wordt oxaalzuur HtweeCtweeOF4
CtweeOF4twee- + H.tweeO → HCtweeOF4- + Oh-
HCtweeOF4- + H.tweeO → HtweeCtweeOF4 + Oh-
Aanwezigheid in de natuur
In mineralen
Calciumoxalaat is het meest voorkomende oxalaat en komt in de vorm van de mineralen whewelliet, weddelliet en caoxiet..
Whewellite is het monohydraat CaCtweeOF4 •H.tweeOf en is de meest stabiele vorm van deze verbinding.

Weddellite is het dihydraat CaCtweeOF4 •2HtweeO en is minder stabiel dan monohydraat.

Caoxiet is calciumoxalaattrihydraat CaCtweeOF4 •3HtweeOF.
In planten en schimmels
Calciumoxalaat wordt aangetroffen in verband met droge bodems en bladeren, ook met pathogene schimmels, vrij, in symbiose of geassocieerd met planten. In de laatste worden kristallen gevormd door het neerslaan van calcium in de vorm van zijn oxalaat..
CaC-vormingtweeOF4 door schimmels heeft een belangrijke invloed op de biologische en geochemische processen van bodems, aangezien het een calciumreserve vormt voor het ecosysteem.
Aanwezigheid in het menselijk lichaam en zoogdieren
Oxalaat vindt zijn oorsprong in de lever, in rode bloedcellen of erytrocyten, en in mindere mate in de nieren. Het wordt gevormd door het metabolisme van aminozuren (zoals fenylalanine en tryptofaan) en door oxidatie van glyoxaaldialdehyde,.
Ook vitamine C kan worden omgezet in oxalaat bij het uitoefenen van zijn antioxiderende functie.
Calciumoxalaat wordt aangetroffen in stenen die zich vormen in de nieren van mensen of dieren met een nieraandoening..
De zogenaamde calciumoxalaatstenen of -stenen worden gevormd door de kristallisatie of aggregatie van CaCtweeOF4 in urine die oververzadigd is met calcium en oxalaat. Dit betekent dat de urine zoveel calcium en oxalaat bevat dat het niet mogelijk is dat deze verbinding opgelost blijft, maar eerder neerslaat of in de vorm van kristallen overgaat in de vaste toestand..
In mensen
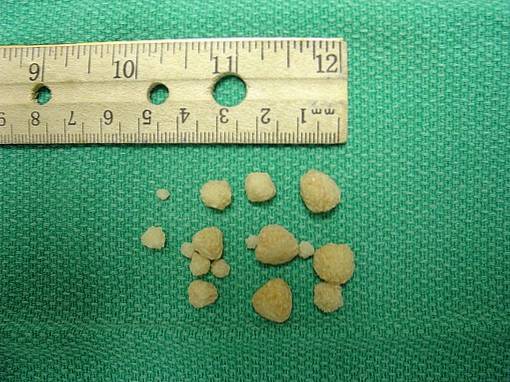
De vorming van gruis of stenen in de nieren is een ziekte die nephrolithiasis wordt genoemd; valt ongeveer 10% van de bevolking aan en ongeveer 75% van deze stenen zijn samengesteld uit calciumoxalaat CaCtweeOF4.
De vorming en groei van calciumoxalaatkristallen in de nier vindt plaats doordat bij sommige mensen de urine oververzadigd is met dit zout. Calciumoxalaat ontwikkelt zich in zure urine bij een pH van minder dan 6,0.
Oververzadiging treedt op wanneer de uitscheiding of eliminatie van dit zout (dat zeer slecht oplosbaar is in water) in de urine plaatsvindt in een kleine hoeveelheid water..
Factoren die het uiterlijk van stenen in de nieren beïnvloeden
Tot de factoren die de vorming van calciumoxalaatgruis bevorderen, behoren een teveel aan calcium in de urine of hypercalciurie, een teveel aan oxalaat in de urine of hyperoxalurie, elementen afgeleid van voeding en de afwezigheid van remmers..
Overtollig oxalaat kan optreden als er onder andere grote hoeveelheden spinazie, rabarber, soja, noten en chocolade worden gegeten..

Er zijn echter stoffen die steenvorming remmen of voorkomen. Verbindingen die steenvorming voorkomen, zijn onder meer kleine moleculen zoals citraat en pyrofosfaat, en grote moleculen zoals glycoproteïnen en proteoglycanen..
Manieren om de vorming van calciumoxalaatstenen te voorkomen
Een goede strategie om herhaling van grit- of calciumoxalaatstenen te voorkomen, is het verhogen van uw vochtinname, het verhogen van uw inname van calciumrijk voedsel (zoals zuivelproducten) en het beperken van keukenzout (NaCl), dierlijk eiwit en voedsel dat rijk is aan oxalaat..
Bij dieren
Sinds het begin van het jaar 2000 is er een toename van calciumoxalaatstenen waargenomen in de urinewegen van katten en honden. Het lijkt erop dat dit afhangt van het soort dieet dat deze dieren eten en heeft te maken met de zuurgraad van de urine en magnesium (Mg) tekort..
Lichaamsreactie op overmatig oxalaat
Er zijn aanwijzingen dat zowel mensen als dieren op een teveel aan oxalaat reageren door het aantal bacteriën dat oxalaat kan afbreken, te verhogen..
Sommige van deze bacteriën zijn Oxalobacter formigenes, Bifidobacterium sp., Porphyromonas gingivalis Y Bacillus sp., onder andere, en zijn van nature aanwezig in de darm.
Toepassingen
Volgens geraadpleegde bronnen wordt calciumoxalaat gebruikt in keramische coatings.
Het is gebruikt om kalkstenen sculpturen en andere artistieke elementen te coaten, en het is gebleken dat het de hardheid van het materiaal verbetert, de porositeit vermindert en de weerstand tegen zuren en logen verhoogt..

Problemen bij sommige processen
In de pulp- en papierindustrie kan calciumoxalaat kalkaanslag vormen, wat veel problemen in het proces veroorzaakt..
Om de vorming ervan in de kanalen of leidingen van industriële processen te voorkomen, is de enzymatische afbraak van oxaalzuur voorgesteld door middel van enzymen zoals oxalaatoxidase..
Het heeft ook de neiging zich als steen op te hopen in de containers waarin bier wordt gemaakt, vanwaar het moet worden verwijderd om de vorming van micro-organismen te voorkomen die de drank een onaangename smaak kunnen geven..
Risico's
In hoge concentraties kan oxalaat de dood veroorzaken bij dieren en soms bij mensen, voornamelijk vanwege de corrosieve effecten..
Ophoping van oxalaat en zijn geconjugeerd zuur, oxaalzuur, kan aandoeningen veroorzaken zoals hartfalen, calciumoxalaatstenen, nierfalen en zelfs de dood door toxiciteit.
Referenties
- Glasauer, S.M. et al. (2013). Metalen en metalloïden, transformatie door micro-organismen. Oxalaten. In referentiemodule in aardesystemen en milieuwetenschappen. Opgehaald van sciencedirect.com.
- Baumann, J. M. en Casella, R. (2019). Preventie van calciumnefrolithiasis: de invloed van diurese op calciumoxalaatkristallisatie in urine. Adv Prev Med, 2019; 2019: 3234867. Opgehaald van ncbi.nlm.nih.gov.
- Breshears, M.A. en Confer, A.W. (2017). Het urinewegstelsel. Calciumoxalaat Calculi. In Pathologic Basis of Veterinary Disease (zesde editie). Opgehaald van sciencedirect.com.
- Huang, Y. er al. (2019). Behandeling van oxalaat in het lichaam en de oorsprong van oxalaat in calciumoxalaatstenen. Urol Int, 5 december 2019: 1-10. Opgehaald van ncbi.nlm.nih.gov.
- Nilvebrant, N.-O. et al. (2002). Biotechnologie in de pulp- en papierindustrie. In uitvoering in biotechnologie. Opgehaald van sciencedirect.com.
- Pahira, J.J. en Pevzner, M. (2007). Nephrolithiasis. Calciumstenen. In Penn Clinical Manual of Urology. Opgehaald van sciencedirect.com.
- Worcester, E. M. (1994). Calciumoxalaatkristalgroeiremmers in de urine. J Am Soc Nephrol 1994 nov; 5 (5 Suppl 1): S46-53). Opgehaald van jasn.asnjournals.org.
- Finkielstein, V.A. en Goldfarb, D.S. (2006). Strategieën om calciumoxalaatstenen te voorkomen. Opgehaald van ncbi.nlm.nih.gov.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Calciumoxalaat. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Peck, A.B. et al. (2015). Oxalaat-afbrekende micro-organismen of oxalaat-afbrekende enzymen: wat is de toekomstige therapie voor het enzymatisch oplossen van calciumoxalaat-urolieten bij terugkerende steenziekte? Urolithiasis, 2016 feb; 44 (1): 27-32. Opgehaald van ncbi.nlm.nih.gov.
- Holames, R.P. et al. (2016). Verlaging van de uitscheiding van oxalaat in de urine om de calciumoxalaatsteenziekte te verminderen. Urolithiasis. 2016 februari; 44 (1); 27-32. Opgehaald van ncbi.nlm.nih.gov.
- Cezar, T.M. (1998). Calciumoxalaat: een oppervlaktebehandeling voor kalksteen. Journal of Conservation and Museum Studies 4, pp. 6-10. Opgehaald van jcms-journal.com.
- Wikimedia (2019). Calciumoxalaat. Opgehaald van en.wikipedia.org.



Niemand heeft nog op dit artikel gereageerd.