
Peroxidases structuur, functies en types
De peroxidasen Het zijn voor het grootste deel hemeproteïnen met enzymatische activiteit die de oxidatie katalyseren van een grote verscheidenheid aan organische en anorganische substraten met behulp van waterstofperoxide of andere verwante stoffen..
In de ruimste zin omvat de term "peroxidase" enzymen zoals NAD- en NADP-peroxidasen, vetzuurperoxidasen, cytochroomperoxidasen, glutathionperoxidasen en vele andere niet-specifieke enzymen..
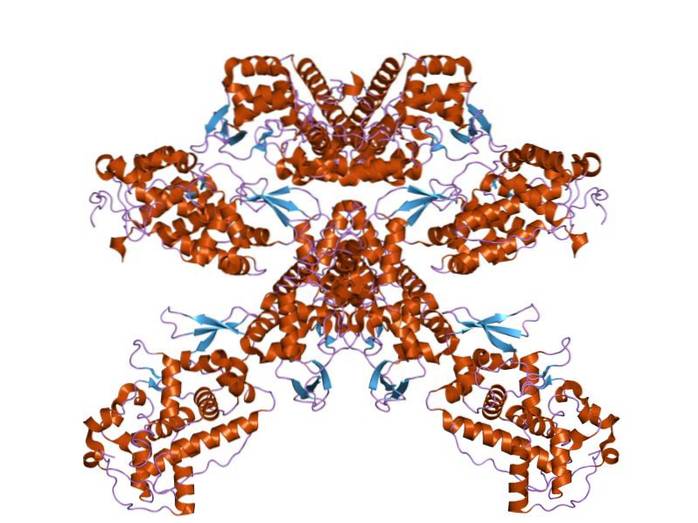
Het wordt echter vaker gebruikt om te verwijzen naar niet-specifieke enzymen uit verschillende bronnen die oxidoreductase-activiteit hebben en die waterstofperoxide en andere substraten gebruiken om hun oxidatiereductiereacties te katalyseren..
Heemperoxidasen komen zeer veel voor in de natuur. Komt voor in dieren, hogere planten, gisten, schimmels en bacteriën.
Bij zoogdieren worden deze geproduceerd door witte bloedcellen, de baarmoeder, milt en lever, speekselklieren, maagwand, longen, schildklier en andere weefsels..
In planten zijn de plantensoorten die het rijkst zijn aan peroxidasen mierikswortel- en vijgenbomen. Peroxidase gezuiverd uit mierikswortel is uitgebreid bestudeerd en gebruikt voor verschillende doeleinden in de experimentele biologie en biochemie..
In eukaryote cellen worden deze belangrijke enzymen gewoonlijk aangetroffen in gespecialiseerde organellen die bekend staan als "peroxisomen", die zijn omgeven door een enkel membraan en betrokken zijn bij talrijke cellulaire metabolische processen..
Artikel index
- 1 Structuur
- 2 functies
- 2.1 Werkingsmechanisme
- 3 soorten
- 3.1 -Volgens het lichaam
- 3.2 - Volgens de actieve site
- 4 referenties
Structuur
Ondanks de weinige homologie die bestaat tussen de verschillende klassen van peroxidasen, is vastgesteld dat hun secundaire structuur en de manier waarop deze is georganiseerd redelijk geconserveerd is tussen de verschillende soorten..
Er zijn enkele uitzonderingen, maar de meeste peroxidasen zijn glycoproteïnen en men neemt aan dat koolhydraten bijdragen aan hun stabiliteit bij verhoogde temperaturen..
Deze eiwitten hebben molecuulgewichten variërend van 35 tot 150 kDa, wat overeenkomt met ongeveer 250 en 730 aminozuurresiduen..
Met uitzondering van myeloperoxidase bevatten alle moleculen van dit type in hun structuur een heemgroep die in rusttoestand een ijzeratoom heeft in de Fe + 3 oxidatietoestand. Planten bezitten een prothetische groep die bekend staat als ferroporfyrine XI.
Peroxidasen hebben twee structurele domeinen die de heemgroep "omringen" en elk van deze domeinen is het product van de expressie van een gen dat een duplicatiegebeurtenis onderging. Deze structuren zijn samengesteld uit meer dan 10 alfa-helices die zijn verbonden door polypeptidelussen en -draaiingen..
De juiste vouwing van het molecuul lijkt af te hangen van de aanwezigheid van geconserveerde glycine- en prolineresiduen, evenals van een asparaginezuurresidu en een arginineresidu die een zoutbrug tussen beide vormen die beide structurele domeinen met elkaar verbindt..
Kenmerken
De belangrijkste functie van peroxidase-enzymen is de verwijdering van waterstofperoxide uit de cellulaire omgeving, die kan worden geproduceerd door verschillende mechanismen en die een ernstige bedreiging kunnen vormen voor de intracellulaire stabiliteit..
Bij dit proces van verwijdering van deze reactieve zuurstofsoort (waarin zuurstof een tussenliggende oxidatietoestand heeft), gebruiken peroxidasen het oxiderende vermogen van deze stof om andere belangrijke functies voor het metabolisme te vervullen..
In planten zijn deze eiwitten een belangrijk onderdeel van de verhoutingsprocessen en afweermechanismen in weefsels die zijn geïnfecteerd met ziekteverwekkers of die fysieke schade hebben opgelopen..
In de wetenschappelijke context zijn er nieuwe toepassingen ontstaan voor peroxidasen en deze omvatten de behandeling van afvalwater dat fenolische verbindingen bevat, de synthese van aromatische verbindingen en de verwijdering van peroxide uit voedsel of afvalmaterialen..
In analytische en diagnostische termen is mierikswortelperoxidase misschien wel het meest gebruikte enzym voor de bereiding van geconjugeerde antilichamen die worden gebruikt voor immunologische absorptietests zoals ELISA. "Enzyme-linked immunosorbent assay") en ook voor de bepaling van verschillende soorten verbindingen.
Werkingsmechanisme
Het katalytische proces van peroxidasen vindt plaats via opeenvolgende stappen die beginnen met de interactie tussen de actieve plaats van het enzym en waterstofperoxide, dat het ijzeratoom in de heemgroep oxideert en een onstabiele tussenverbinding genereert die bekend staat als verbinding I (CoI)..
Het geoxideerde eiwit (CoI) heeft dan een heemgroep met een ijzeratoom dat van oxidatietoestand III naar toestand IV ging en voor dit proces werd waterstofperoxide gereduceerd tot water.
Verbinding I is in staat om een elektronendonorsubstraat te oxideren, een substraatradicaal te vormen en een nieuwe chemische soort te worden die bekend staat als verbinding II (CoII), die vervolgens wordt gereduceerd door een tweede substraatmolecuul, ijzer regenereert in toestand III en een ander radicaal produceert..
Types
-Volgens het lichaam
Peroxidasen zijn gegroepeerd in drie klassen, afhankelijk van het organisme waarin ze worden aangetroffen:
- Klasse I: intracellulaire prokaryote peroxidasen.
- Klasse II: extracellulaire schimmelperoxidasen.
- Klasse III: uitgescheiden plantaardige peroxidasen.
In tegenstelling tot klasse I-eiwitten, hebben die van klasse II en III disulfidebruggen tussen cysteïneresiduen in hun structuren, waardoor ze een aanzienlijk grotere stijfheid krijgen..
Klasse II- en III-eiwitten verschillen ook van klasse I doordat ze over het algemeen glycosyleringen op hun oppervlak hebben..
-Volgens de actieve site
Mechanistisch gezien kunnen peroxidasen ook worden gecategoriseerd volgens de aard van de atomen die in hun katalytische centrum worden aangetroffen. Op deze manier worden hemoperoxidasen (de meest voorkomende), vanadium-haloperoxidasen en andere.
Hemoperoxidasen
Zoals reeds vermeld, hebben deze peroxidasen een prothetische groep in hun katalytische centrum die bekend staat als de heemgroep. Het ijzeratoom op deze plaats wordt gecoördineerd door vier bindingen met de stikstofatomen..
Vanadium-haloperoxidasen
In plaats van een heemgroep bezitten vanadium-haloperoxidasen vanadaat als een prothetische groep. Deze enzymen zijn geïsoleerd uit mariene organismen en sommige landschimmels.
Het vanadium in deze groep wordt gecoördineerd door drie niet-eiwit zuurstofatomen, een stikstof uit een histidineresidu en een stikstof uit een azidebinding..
Andere peroxidasen
Veel bacteriële haloperoxidasen die andere prothetische groepen dan heem of vanadium hebben, worden in deze groep ingedeeld. In deze groep bevinden zich ook glutathionperoxidasen, die een seleno-cysteïne-prothetische groep bevatten en enkele enzymen die lignine kunnen oxideren..
Referenties
- Alberts, B., Dennis, B., Hopkin, K., Johnson, A., Lewis, J., Raff, M., ... Walter, P. (2004). Essentiële celbiologie. Abingdon: Garland Science, Taylor & Francis Group.
- Banci, L. (1997). Structurele eigenschappen van peroxidasen. Journal of Biotechnology, 53, 253-263.
- Deurzen, M. P. J. Van, Rantwijk, F. Van, & Sheldon, R. A. (1997). Selectieve oxidaties gekatalyseerd door peroxidasen. Tetraëder, 53(39), 13183-13220.
- Dunford, H. B., & Stillman, J. S. (1976). Over de functie en het werkingsmechanisme van peroxidasen. Coördinatie Chemie beoordelingen, 19, 187-251.
- Hamid, M., & Rehman, K. (2009). Mogelijke toepassingen van peroxidasen. Voedsel scheikunde, 115(4), 1177-1186.
- Rawn, J. D. (1998). Biochemie. Burlington, Massachusetts: uitgeverij Neil Patterson.
- Stansfield, W. D., Colomé, J.S., & Cano, R. J. (2003). Moleculaire en celbiologie. (K. E. Cullen, Ed.). McGraw-Hill eBooks.



Niemand heeft nog op dit artikel gereageerd.