
Waterstofperoxide (H2O2) structuur, eigenschappen, gebruik, productie
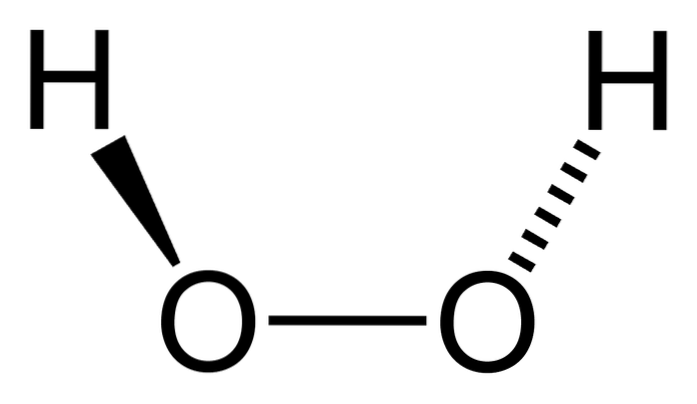
De waterstof peroxide is een anorganische verbinding waarvan de chemische formule H istweeOFtwee. Het is van alles het eenvoudigste peroxide van deze familie van chemische verbindingen. De structuurformule is H-O-O-H, deze interne zuurstofrijke brug die kenmerkend is voor alle peroxiden.
In 1818 werd de H.tweeOFtwee Het werd geïdentificeerd door Louies Jacques Thénard, die een chemische verbinding bereidde die hij destijds waterstofperoxide noemde. Het is een onstabiele verbinding, het ontleedt bij blootstelling aan licht, hitte en sommige metalen.
Het is een zeer nuttige verbinding die wordt gebruikt bij het desinfecteren van kleine wonden, het bleken van haar, waterbehandeling, enz. Hoewel het schadelijke effecten kan hebben op mensen, wordt het aangetroffen in alle eukaryote cellen van levende wezens, waar het verschillende gunstige functies vervult..
Waterstofperoxide produceert de oxidatie van giftige stoffen zoals fenolen, ethanol, formaldehyde, enz., Producten die worden uitgescheiden door de lever en de nieren. Bovendien draagt het bij tot de vernietiging van bacteriën die gefagocyteerd worden door neutrofiele leukocyten en macrofagen..
Artikel index
- 1 Structuur
- 1.1 Molecuul
- 1.2 Rotaties
- 1.3 Intermoleculaire interacties
- 2 Eigenschappen
- 2.1 Namen
- 2.2 Molaire massa
- 2.3 Fysiek uiterlijk
- 2.4 Geur
- 2.5 Smaak
- 2.6 Dichtheid
- 2.7 Smeltpunt
- 2.8 Kookpunt
- 2.9 Oplosbaarheid in water
- 2.10 Oplosbaarheid
- 2.11 Verdelingscoëfficiënt octanol / water
- 2.12 Dampspanning
- 2.13 Dissociatieconstante
- 2,14 pH
- 2.15 Brekingsindex (nD)
- 2.16 Viscositeit
- 2.17 Warmtecapaciteit
- 2.18 Verdampingswarmte
- 2.19 Stabiliteit
- 2.20 Corrosie
- 2.21 Ontleding
- 2.22 Oppervlaktespanning
- 2.23 Reactiviteit
- 3 toepassingen
- 3.1 Bleken
- 3.2 Desinfectiemiddel
- 3.3 Wasmiddel
- 3.4 Cosmetische toepassing
- 3.5 Drijfgas
- 4 Verkrijgen
- 4.1 Hydrogenering
- 4.2 Filtratie
- 4.3 oxidatie
- 4.4 Extractie en zuivering
- 5 Risico's
- 6 referenties
Structuur
Molecuul
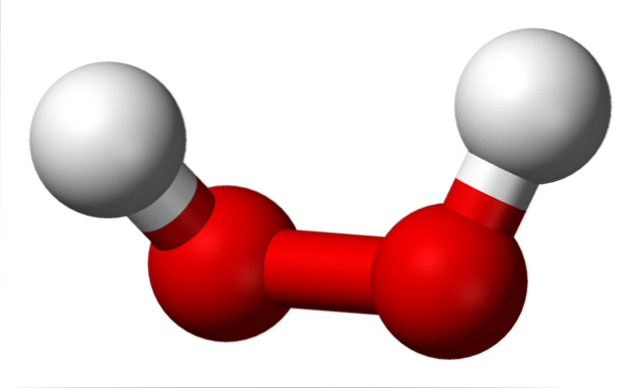
De bovenste afbeelding toont de structuur van het H-molecuultweeOFtwee (H-O-O-H), met de rode bollen die overeenkomen met de zuurstofatomen en de witte met de waterstofatomen. Merk op dat het molecuul niet plat is en dat de H-atomen niet in de ruimte worden overschaduwd (de ene voor de andere).
Interessant is dat de H.tweeOFtwee Het is moeilijk voor het om zijn centrale eenvoudige O-O-binding te roteren, dus de posities van deze H's kunnen niet worden verwisseld; de ene gaat niet naar beneden terwijl de andere omhoog gaat.
Waarom? Omdat er in de twee zuurstofatomen twee vrije elektronenparen zijn, wat in totaal acht zeer nabije elektronen oplevert die elkaar afstoten vanwege hun negatieve ladingen..
Rotaties
Toch is de O-O-binding gevoelig voor lichte rotatie als gevolg van interacties met zijn omgeving..
Door bijvoorbeeld de twee duimen bij elkaar te brengen, met de wijsvingers gestrekt en de andere gesloten, alsof je een baan tekent, en vervolgens de duimen zo te draaien dat een van de wijsvingers naar voren en de andere naar achteren wijst, zul je hebben een geschatte weergave van HtweeOFtwee.
Als een lichaam een van de wijsvingers aanraakt, zullen de duimen draaien als reactie op deze interactie; ze zullen echter onmiddellijk terugkeren naar hun oorspronkelijke positie vanwege de hierboven genoemde elektronische afstotingen. Deze rotaties kaderen dus de dynamische aspecten van dit molecuul.
Intermoleculaire interacties
In vloeibare toestand is de H.tweeOFtwee slaagt erin om waterstofbruggen tot stand te brengen (HOOH-OtweeH.twee), omdat anders het hoge kookpunt (150 ºC) vergeleken met water niet zou worden verklaard.
Zodra het overgaat in de gasfase, de H-moleculentweeOFtwee vermoedelijk kan het dergelijke bruggen niet meer vormen, niet alleen vanwege de grotere intermoleculaire afstand, maar ook zouden de waterstofatomen als eerste aanraken in geval van botsingen (dit kan worden gevisualiseerd door opnieuw gebruik te maken van het vingermodel).
Ondertussen, in de vaste fase, is de hoek van de vlakken bepaald door de H 90 ° (zet de wijsvingers loodrecht). Nu worden waterstofbruggen nog belangrijker en worden H-moleculentweeOFtwee zijn gerangschikt in een kristal met een tetragonale structuur.
Eigendommen
Fles met waterstofperoxide. In apotheken wordt het bereikt met een concentratie van 3% m / v. Bron: Pixnio.
Namen
-Waterstof peroxide
-Antioxidant
-Oxidanol
-Perhydroxic zuur
-O-hydroxyol
-Peroxide
Molaire massa
34,0147 g / mol
Fysiek uiterlijk
Lichtblauwe (geconcentreerde) of kleurloze vloeistof. Het is iets stroperiger en dichter dan water. Het wordt voor de veiligheid gedestilleerd bij lage temperaturen en onder verminderde druk, aangezien het bij verhitting in een explosieve vorm ontleedt.
Geur
Scherpe of ozonachtige geur.
Smaak
Bitter
Dichtheid
Massief 1,71 g / cm3
De dichtheid van zijn waterige oplossingen hangt af van hun concentratie; bij 27% heeft het bijvoorbeeld een dichtheid van 1,10 g / cm3, terwijl bij 50% 1,13 g / cm3
Smeltpunt
- 0,43 ºC
Kookpunt
150,2 ° C. Deze waarde is verkregen door extrapolatie, aangezien waterstofperoxide ontleedt bij hoge temperaturen.
Oplosbaarheid in water
Mengbaar ≥ 100 mg / ml bij 25 ºC
Oplosbaarheid
Het is oplosbaar in ether en alcoholen, maar onoplosbaar in petroleumether. Ontleedt in veel organische oplosmiddelen tot water en zuurstof.
Verdelingscoëfficiënt octanol / water
Log P = - 0,43
Dampdruk
5 mmHg bij 30 ºC.
Dissociatieconstante
pKa = 11,72
pH
Waterstofperoxide-oplossingen zijn licht zuur. Een 35% heeft bijvoorbeeld een pH van 4,6; maar door te concentreren op 90% wordt de pH minder zuur: 5.1.
Brekingsindex (nD
1.4061
Viscositeit
1.245 cPoise bij 20 ºC.
Warmte capaciteit
1267 J / gK (gas)
2.619 J / gK (vloeistof)
Warmte van verdamping
1.519 J / gK
Stabiliteit
Stabiel onder aanbevolen omstandigheden. Het wordt verder gestabiliseerd door de toevoeging van aceetanilide en tinzouten.
Corrosie
Bijtend
Ontleding
Het ontleedt bij blootstelling aan licht of in aanwezigheid van oxiderende en reducerende stoffen. Het ontleedt ook bij verwarming. Wanneer het ontleedt, geeft het water en zuurstof af en wordt het bevorderd door een verhoging van de pH en temperatuur, evenals door de aanwezigheid van het enzym catalase..
Oppervlaktespanning
80,4 dyne / cm bij 20 ° C
Reactiviteit
De HtweeOFtwee Het werkt als een oxidatiemiddel in zure oplossingen van ferro-ijzer (Fetwee+) naar ferri-ijzer (F.3+oxideert ook het sulfietion (SO3twee-) naar sulfaation (SO4twee-.
Het kan ook fungeren als reductiemiddel in aanwezigheid van basische oplossingen, waardoor natriumhypochloriet (NaOCl) en kaliumpermanganaat (KMnO4) met het vrijkomen van zuurstof.
Toepassingen
Bleken
Waterstofperoxide wordt in de papierindustrie gebruikt bij het bleken van pulp en papier, dat het grootste deel van de jaarlijkse productie verbruikt.
Ontsmettingsmiddel
Waterstofperoxide is een mild antisepticum om infectie van kleine wonden, schaafwonden en brandwonden te voorkomen. Het wordt ook gebruikt als mondwater en om milde irritatie van de mond door de aanwezigheid van aften of gingivitis te verlichten..
Het wordt ook gebruikt om oppervlakken, de binnenkant van koelkasten en water te desinfecteren en om overmatige bacteriegroei in watersystemen en koeltorens tegen te gaan. Waterstofperoxide maakt vrije zuurstofradicalen vrij, die verontreinigende stoffen afbreken.
Wasmiddel
Waterstofperoxide wordt gebruikt bij de vervaardiging van wasmiddelen voor het bleken van wasgoed, waaronder natriumpercarbonaat. Deze verbinding is een complex van natriumcarbonaat en waterstofperoxide dat, wanneer het wordt opgelost in water, wordt gescheiden in zijn componenten.
Cosmetische toepassing
Verdund waterstofperoxide wordt gebruikt bij het bleken van het haar, voorafgaand aan het kleuren. Het wordt ook gebruikt om tanden witter te maken, evenals als onderdeel van een zelfgemaakte tandpasta.
Drijfgas
Waterstofperoxide wordt gebruikt als de monostuwstof of oxiderende component van een bipropolente raket. Het ontleedt waarbij zuurstof en water vrijkomen, een eigenschap waardoor het als drijfgas kon worden gebruikt.
Het wordt in een reactiecel gepompt met de aanwezigheid van een katalysator die genoemde ontleding versnelt. Hierbij wordt een hoge temperatuur waterdamp geproduceerd.
Wanneer de stoom door een opening wordt verdreven, produceert deze een impuls. De V-80 onderzeeër, gebouwd in 1940, gebruikte zuurstof gegenereerd uit waterstofperoxide in zijn turbines; noemde het turbinesysteem van Walter.
Het verkrijgen van
Aanvankelijk werd waterstofperoxide industrieel verkregen door hydrolyse van ammoniumpersulfaat, [(NH4tweeStweeOF8] of de elektrolyse van ammoniumbisulfaat, NH4HSO4.
Waterstofperoxide wordt momenteel industrieel verkregen door het gebruik van antrachinon. Het proces verloopt in vier fasen: hydrogenering, filtratie, oxidatie, extractie en zuivering..
Hydrogenering
Alkylantrochinon wordt gehydrogeneerd door waterstofgas door een hydrogenator te leiden die is beladen met aluminiumoxide en een kleine hoeveelheid van de katalysator (palladium). De temperatuur wordt onder voortdurend roeren op 45 ºC gehouden.
Alkyldrochinon wordt omgezet in alkylanthrahydrochinon en tetrahydroalkylanthrahydrochinon, waarbij de laatste wordt geselecteerd vanwege het grotere gemak voor de volgende procedures.
Filtratie
De oplossing die het gehydrogeneerde anthrachinon bevat, wordt gefiltreerd om eventuele sporen van de katalysator te verwijderen..
Oxidatie
De gefilterde oplossing wordt geoxideerd door er lucht doorheen te leiden, waarbij waterstofperoxide met een lage zuiverheid wordt gevormd..
Extractie en zuivering
De oplossing met het waterstofperoxide gaat door een vloeistof-vloeistof extractiekolom. Het water stroomt door de kolom, terwijl de oplossing met het waterstofperoxide erdoorheen wordt gepompt.
Het water bereikt de bodem van de extractor met een waterstofperoxideconcentratie tussen 25 en 35% w / w. Vervolgens wordt het gezuiverd door vacuümdestillatie tot een waterstofperoxideconcentratie van 30%. Eindelijk stabiliseert en slaat op.
Risico's
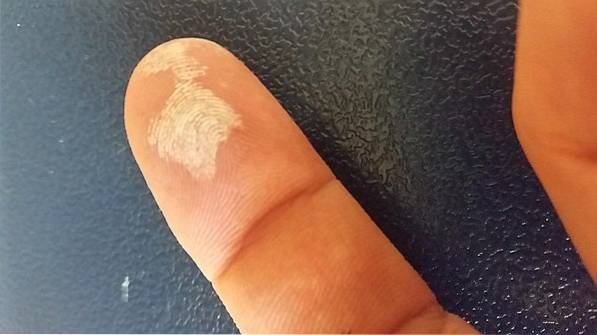
Waterstofperoxide is een bijtend middel, dus bij contact met de huid veroorzaakt het ernstige irritatie, evenals een tijdelijke bleekheid (afbeelding hierboven). Het kan ook oogletsel, jeuk, uitslag, roodheid en blaarvorming veroorzaken..
Inademing veroorzaakt irritatie van de neus, keel en longen. Ondertussen kan herhaalde blootstelling bronchitis, hoesten, slijm en kortademigheid veroorzaken. En alsof het nog niet genoeg is, veroorzaakt het ook hoofdpijn, duizeligheid, misselijkheid en braken.
Ernstige blootstelling aan waterstofperoxide kan ervoor zorgen dat vloeistof zich ophoopt in de longen, bekend als longoedeem - een ernstige aandoening die onmiddellijke medische aandacht vereist..
De Occupational Safety and Health Administration (OSHA) heeft het maximaal toegestane waterstofperoxide vastgesteld van 1 ppm in een werkomgeving in een 8-urige ploeg. Omdat het echter een mutagene stof is, moet de blootstelling tot een minimum worden beperkt..
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Waterstof peroxide. Hersteld van: en.wikipedia.org
- William R. Busing en Henri A. Levy. (2004). Kristal- en moleculaire structuur van waterstofperoxide: een neutronen-diffractiestudie. doi.org/10.1063/1.1696379
- Nationaal centrum voor informatie over biotechnologie. (2019). Waterstof peroxide. PubChem-database. CID = 784. Hersteld van: pubchem.ncbi.nlm.nih.gov
- De redactie van Encyclopaedia Britannica. (27 november 2018). Waterstof peroxide. Encyclopædia Britannica. Hersteld van: britannica.com
- Ministerie van Volksgezondheid van New Jersey. (2016). Waterstof peroxide. [Pdf]. Hersteld van: nj.gov
- Mathews, C. K., Van Holde, K. E., Ahern, K. G. (2002). Biochemie. Derde editie. Uitgever Pearson Addison Wesley
- Web MD. (2019). Waterstof peroxide. Hersteld van: webmd.com


Niemand heeft nog op dit artikel gereageerd.