
Natriumperoxide (Na2O2) structuur, eigenschappen, gebruik

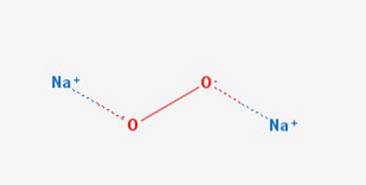
De natriumperoxide is een chemische verbinding met formule NatweeOFtwee Het heeft twee ionische bindingen tussen de twee natriumatomen en het O2-molecuul. Het komt voor in verschillende hydraten en peroxyhydraten, waaronder NatweeOFtwee 2HtweeOFtwee 4HtweeOp eentweeOFtwee 2HtweeOp eentweeOFtwee 2HtweeOFtwee en NatweeOFtwee 8HtweeOF.
Het heeft een hexagonale kristallijne structuur, maar bij verhitting ondergaat deze vorm een overgang naar een fase met onbekende symmetrie bij 512 ° C.De kristallijne structuur wordt getoond in figuur 2 (Natrium: natriumperoxide, 1993-2016).

Natriumperoxide kan op grote schaal worden bereid door metallisch natrium te laten reageren met zuurstof bij 130-200 ° C (Ashford, 1994), een proces dat natriumoxide genereert, dat in een aparte fase zuurstof absorbeert:
4 Na + Otwee → NatweeOF
2 NatweeO + Otwee → 2 nbtweeOFtwee
Het onderhavige batchproces omvat de oxidatie van natrium in natriummonoxide met droge lucht en daaropvolgende oxidatie van het monoxide in peroxide met 90% zuurstof..
In 1951 begon USI met het eerste continue proces voor de productie van natriumperoxide. Het proces is in één opzicht uniek: er wordt lucht gebruikt in plaats van pure zuurstof.
Variaties van een batchproces worden al bijna 70 jaar gebruikt (SCHOW, 1957), het commerciële product bevat bijvoorbeeld tussen 90 en 95% waterstofperoxide.
Artikel index
- 1 Fysische en chemische eigenschappen van natriumperoxide
- 2 Reactiviteit en gevaren
- 3 toepassingen
- 4 referenties
Fysische en chemische eigenschappen van natriumperoxide
Natriumperoxide is een gelige korrelige vaste stof die geel wordt in contact met de atmosfeer (National Center for Biotechnology Information, S.F.). Hun uiterlijk wordt geïllustreerd in figuur 3.

Natriumperoxide heeft een molecuulgewicht van 77,98 g / mol en een dichtheid van 2,805 g / ml. De verbinding heeft een smeltpunt van 460,00 ° C, waar het begint te ontleden tot natriumoxide en moleculaire zuurstof volgens de reactie:
2 Na2O2 → 2 Na2O + O2
Het kookpunt is 657 ° C (Royal Society of Chemistry, 2015).
Natriumperoxide reageert heftig met reductiemiddelen, brandbare materialen en lichte metalen. Reageert exotherm en snel of zelfs explosief met water om een sterke base (NaOH) en zuurstof (O2) te vormen.
Een mengsel met ammoniumpersulfaat kan exploderen als het wordt blootgesteld aan wrijving (vermalen in een mortel), als het wordt verwarmd of als er een stroom kooldioxidegas overheen wordt geleid..
Reageert zeer heftig met waterstofsulfidegas. Zelfs als er geen lucht is, kan de reactie gepaard gaan met een vlam. Een explosie treedt op wanneer kooldioxidegas over een mengsel van natriumperoxide en magnesiumpoeder wordt geleid..
Mengsels met azijnzuur of azijnzuuranhydride kunnen exploderen als ze niet koud worden gehouden. Ze zijn spontaan ontvlambaar in contact met aniline, benzeen, diethylether of organische materialen zoals papier en hout..
Mengsels met houtskool, glycerine, bepaalde oliën en fosfor verbranden of exploderen. Een mengsel met calciumcarbide (poeder) kan in vlammen opgaan bij blootstelling aan vochtige lucht en exploderen bij verhitting.
Het ontleedt, vaak heftig in aanwezigheid van katalytische hoeveelheden mangaandioxide. Het mengsel met zwavelmonochloride leidt tot een heftige reactie. Het kan reageren en de ontbranding van brandstoffen veroorzaken (SODIUM PEROXIDE, 2016).
Reactiviteit en gevaren
Natriumperoxide is een verbinding die is geclassificeerd als een sterke base, explosief en sterk oxidatiemiddel op basis van zijn reactiviteitswaarschuwing. Mengsels met brandbaar materiaal worden gemakkelijk ontstoken door wrijving, hitte of contact met vocht.
Kan bij langdurige blootstelling aan hitte krachtig ontleden, waardoor containers die het bevatten, breken.
Zeer gevaarlijk bij contact met huid en ogen (irriterend) en bij inslikken en inademen. Langdurige blootstelling kan brandwonden en zweren op de huid veroorzaken. Overmatige blootstelling door inademing kan irritatie van de luchtwegen veroorzaken..
Ontsteking van het oog wordt gekenmerkt door roodheid, tranen en jeuk. Ontsteking van de huid wordt gekenmerkt door jeuk, schilfering, roodheid of soms blaarvorming.
Bij oogcontact moet u controleren of u contactlenzen draagt en deze uitdoen. Ogen moeten onmiddellijk worden gespoeld met stromend water gedurende minstens 15 minuten, waarbij de oogleden open blijven..
Bij huidcontact wordt de besmette huid voorzichtig en voorzichtig met stromend water en niet-schurende zeep gewassen. Koud water kan worden gebruikt. Een geïrriteerde huid moet worden bedekt met een verzachtend middel.
Als het contact met de huid ernstig is, moet deze worden gewassen met een desinfecterende zeep en de besmette huid bedekken met een antibacteriële crème..
Bij inademing moet het slachtoffer rusten in een goed geventileerde ruimte..
Evacueer het slachtoffer zo snel mogelijk naar een veilige plaats. Maak strak zittende kleding los, zoals een overhemdkraag, riem of stropdas. Bij ademhalingsmoeilijkheden zuurstof toedienen. Als het slachtoffer niet ademt, voer dan mond-op-mondbeademing uit.
Bij inslikken mag braken niet worden opgewekt. Als het slachtoffer niet ademt, voer dan mond-op-mondbeademing uit.
Zoek in alle gevallen onmiddellijk medische hulp (Veiligheidsinformatieblad Natriumperoxide, 2013).
Toepassingen
Natriumperoxide wordt gebruikt in bleekmiddelen voor kleding, omdat het reageert met water om waterstofperoxide te produceren, een bleekmiddel volgens de reactie:
NatweeOFtwee + 2 uurtweeO → 2 NaOH + HtweeOFtwee
Naast waterstofperoxide produceert de reactie natriumhydroxide (loog), waardoor de oplossing alkalisch blijft. Heet water en een alkalische oplossing zijn beide nodig om waterstofperoxide het beste als bleekmiddel te laten werken (Field, S.F.).
Natriumperoxide wordt gebruikt om houtpulp te bleken voor de productie van papier en textiel. Het wordt momenteel voornamelijk gebruikt voor gespecialiseerde laboratoriumwerkzaamheden, bijvoorbeeld de winning van delfstoffen. Bovendien wordt natriumperoxide gebruikt als oxidatiemiddel bij chemische reacties..
Het wordt ook gebruikt als een bron van zuurstof door het te laten reageren met kooldioxide om zuurstof en natriumcarbonaat te produceren, daarom is het vooral nuttig in duikuitrusting, onderzeeërs, enz. (Natriumperoxide gebruiken om kooldioxide-emissies te schrobben, 2014).
Referenties
- Ashford, R. (1994). Ashford's Dictionary of Industrial Chemicals. Londen: Publications Ltd.
- Field, S. (S.F.). Ingrediënten-natriumperoxide. Opgehaald van sci-toys.com.
- Veiligheidsinformatieblad Natriumperoxide. (2013, 21 mei). Opgehaald van sciencelab.com.
- Nationaal centrum voor informatie over biotechnologie. (S.F.). PubChem samengestelde database; CID = 14803. Opgehaald van PubChem.
- Royal Society of Chemistry. (2015). Natriumperoxide. Opgehaald van chemspider.com.
- SCHOW, H. R. (1957). Het verhaal over de productie van natriumperoxide. Advances in Chemistry, deel 19, 118-123.
- NATRIUMPEROXIDE. (2016). Opgehaald van cameochemicaliën.
- Natrium: natriumperoxide. (1993-2016). Opgehaald uit webelementen.
- Natriumperoxide gebruiken om kooldioxide-emissies te verwijderen. (2014, 10 november). Opgehaald van stackexchange.

Niemand heeft nog op dit artikel gereageerd.