
Droge celstructuur en functie
EEN droge cel het is een batterij waarvan het elektrolytische medium bestaat uit een pasta en niet uit een oplossing. Deze pasta heeft echter een bepaalde vochtigheidsgraad en is om deze redenen niet strikt droog..
De kleine hoeveelheid water is voldoende om de ionen te laten bewegen en bijgevolg de elektronenstroom in de cel..

Het enorme voordeel ten opzichte van de eerste natte batterijen is dat omdat het een elektrolytische pasta is, de inhoud niet kan worden gemorst; wat het geval was met natte batterijen, die gevaarlijker en kwetsbaarder waren dan hun droge tegenhangers. Gezien de onmogelijkheid van morsen, wordt de droge cel gebruikt in veel draagbare en mobiele apparaten.
In de afbeelding hierboven is er een droge zink-koolstofbatterij. Om precies te zijn, het is een moderne versie van de Georges Leclanché-stack. Het is van alles de meest voorkomende en misschien wel de eenvoudigste.
Deze apparaten vertegenwoordigen een energetisch gemak vanwege het feit dat ze chemische energie in de zak hebben die kan worden omgezet in elektriciteit; en op deze manier niet afhankelijk zijn van stopcontacten of de energie die wordt geleverd door grote energiecentrales en hun uitgebreide netwerk van torens en kabels.
Artikel index
- 1 Structuur van de droge cel
- 1.1 Elektroden
- 1.2 Terminals
- 1.3 Zand en was
- 2 Werking
- 2.1 Oxidatie van de zinkelektrode
- 2.2 Reductie van ammoniumchloride
- 2.3 Downloaden
- 3 referenties
Droge celstructuur
Wat is de structuur van een droge cel? Op de afbeelding zie je de hoes, die niets meer is dan een polymeerfilm, staal en de twee aansluitingen waarvan de isolerende ringen aan de voorkant uitsteken.
Dit is echter alleen zijn uiterlijk; de belangrijkste onderdelen liggen aan de binnenkant, wat de goede werking ervan garandeert.
Elke droge cel zal zijn eigen kenmerken hebben, maar alleen de zink-koolstofcel komt in aanmerking, waarvan een algemene structuur voor alle andere batterijen kan worden geschetst..
Batterij wordt opgevat als de vereniging van twee of meer batterijen, en de laatste zijn voltaïsche cellen, zoals in een toekomstige sectie zal worden uitgelegd..
Elektroden
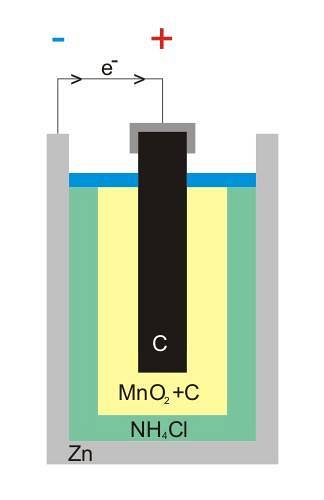
De bovenste afbeelding toont de interne structuur van een zink-koolstofbatterij. Wat de voltaïsche cel ook is, er zouden altijd (meestal) twee elektroden moeten zijn: een waaruit elektronen worden afgegeven en een andere die ze ontvangt..
Elektroden zijn elektrisch geleidende materialen en om stroom te kunnen krijgen, moeten beide verschillende elektronegativiteiten hebben.
Zink, een wit blikje dat de batterij omhult, is bijvoorbeeld waar de elektronen naar het elektrische circuit (apparaat) gaan waar het is aangesloten.
Aan de andere kant bevindt zich in het hele medium de grafietkoolstofelektrode; ook ondergedompeld in een pasta samengesteld uit NH4Cl, ZnCltwee en MnOtwee.
Deze elektrode is degene die de elektronen ontvangt en merk op dat deze het symbool '+' heeft, wat betekent dat het de positieve pool van de batterij is.
Terminals
Zoals te zien is boven de grafietstaaf in de afbeelding, is er de positieve elektrische aansluiting; en daaronder, de binnenste zinkbus waaruit elektronen stromen, de negatieve pool.
Daarom hebben de batterijen '+' of '-' markeringen om de juiste manier aan te geven om ze op het apparaat aan te sluiten en zo in te schakelen..
Zand en was
Hoewel niet getoond, wordt de pasta beschermd door een bufferzand en een lakzegel die voorkomt dat het morst of in contact komt met het staal onder kleine mechanische schokken of agitatie..
Functioneren
Hoe werkt een droge cel? Om te beginnen is het een voltaïsche cel, dat wil zeggen dat het elektriciteit opwekt uit chemische reacties. Daarom vinden binnen cellen redoxreacties plaats, waarbij de soort elektronen wint of verliest..
De elektroden dienen als een oppervlak dat de ontwikkeling van deze reacties vergemakkelijkt en mogelijk maakt. Afhankelijk van hun ladingen kan oxidatie of reductie van de soort optreden.
Om dit beter te begrijpen, worden alleen de chemische aspecten van de zink-koolstofbatterij toegelicht..
Oxidatie van zinkelektroden
Zodra het elektronische apparaat wordt ingeschakeld, zal de batterij elektronen vrijgeven door de zinkelektrode te oxideren. Dit kan worden weergegeven door de volgende chemische vergelijking:
Zn => Zntwee+ + 2e--
Als er veel Zntwee+ rondom het metaal zal een positieve ladingspolarisatie optreden, waardoor er geen verdere oxidatie zal plaatsvinden. Daarom is de Zntwee+ moet door de pasta naar de kathode diffunderen, waar de elektronen terugkomen.
Zodra de elektronen het artefact hebben geactiveerd, keren ze terug naar de andere elektrode: de grafiet, om een chemische soort te vinden die erop wacht..
Ammoniumchloride-reductie
Zoals eerder vermeld, zit er NH in pasta4Cl en MnOtwee, stoffen die de pH zuur maken. Zodra de elektronen binnenkomen, treden de volgende reacties op:
2NH4+ + 2e- => 2NH3 + H.twee
De twee producten, ammoniak en moleculaire waterstof, NH3 en Htwee, het zijn gassen en daarom kunnen ze de batterij "doen opzwellen" als ze geen andere transformaties ondergaan; zoals de volgende twee:
Zntwee+ + 4NH3 => [Zn (NH34twee+
H.twee + 2MnOtwee => 2MnO (OH)
Merk op dat het ammonium werd gereduceerd (gewonnen elektronen) om NH te worden3. Deze gassen werden vervolgens geneutraliseerd door de andere componenten van de pasta..
Het complex [Zn (NH34twee+ vergemakkelijkt de diffusie van Zn-ionentwee+ richting de kathode en zo voorkomen dat de batterij "vastloopt".
Het externe circuit van het artefact fungeert als een brug voor de elektronen; anders zou er nooit een directe verbinding zijn tussen de zinkbus en de grafietelektrode. In de afbeelding van de structuur zou dit circuit de zwarte kabel vertegenwoordigen.
Downloaden
Droge cellen zijn er in vele varianten, maten en werkspanningen. Sommigen van hen zijn niet oplaadbaar (primaire voltaïsche cellen), terwijl andere zijn (secundaire voltaïsche cellen).
De zink-koolstofbatterij heeft een werkspanning van 1,5V. Hun vormen veranderen op basis van hun elektroden en de samenstelling van hun elektrolyten..
Er zal een punt komen waarop alle elektrolyt heeft gereageerd, en ongeacht hoeveel zink wordt geoxideerd, er zal geen soort zijn die de elektronen ontvangt en hun afgifte bevordert..
Daarnaast kan het voorkomen dat de gevormde gassen niet meer geneutraliseerd worden en druk blijven uitoefenen in de accu's..
Zink-koolstofbatterijen en andere batterijen die niet oplaadbaar zijn, moeten worden gerecycled; omdat de componenten ervan, met name nikkel-cadmiumcomponenten, schadelijk zijn voor het milieu door bodem- en waterverontreiniging.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- De "Dry-Cell" -batterij. Hersteld van: makahiki.kcc.hawaii.edu
- Hoffman S. (10 december 2014). Wat is een droge-celbatterij? Hersteld van: upsbatterycenter.com
- Onkruid, Geoffrey. (24 april 2017). Hoe werken droge celbatterijen? Wetenschappelijk. Hersteld van: sciencing.com
- Woodford, Chris. (2016) Batterijen. Hersteld van: explaininthatstuff.com.



Niemand heeft nog op dit artikel gereageerd.