
Karakteristieke prionen, structuur, functies, ziekten
De prionen het zijn eiwitten zonder genoom of nucleïnezuren die als infectieuze agentia werken. De term "prion" betekent proteïneachtig infectieus deeltje (uit het Engels Proteinaceous Infectious Particles), en werd bedacht door de neuroloog en Nobelprijswinnaar, Stanley B. Prusiner.
In 1982 identificeerden Prusiner en zijn collega's een besmettelijk eiwitdeeltje, terwijl ze de oorzaken van de ziekte van Creutzfeldt-Jakob (bij mensen) en boviene spongiforme encefalopathie bestudeerden..
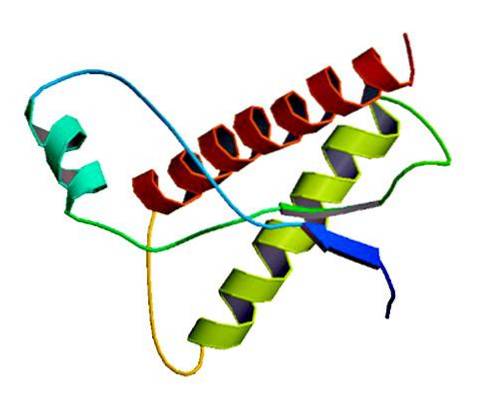
Deze zeldzame infectieuze agentia worden alleen in het membraan van normale cellen aangetroffen als verkeerd gevouwen eiwitten en / of met een abnormale driedimensionale structuur. Deze eiwitten zijn verantwoordelijk voor meerdere degeneratieve ziekten en een zeer hoge mortaliteit die het zenuwweefsel en de structuur van de hersenen aantasten..
Ze worden ook wel prionziekten genoemd. Tot de belangrijkste die mensen treffen, behoren kuru, de ziekte van Gerstmann-Sträussler-Scheinker, het Creutzfeldt-Jakob-syndroom en fatale familiale slapeloosheid..
Artikel index
- 1 Algemene kenmerken
- 2 Structuren
- 2.1 PrP (C)
- 2.2 PrP (Sc)
- 3 functies
- 3.1 Met metabotrope glutamaatreceptoren
- 3.2 In embryonale ontwikkeling
- 3.3 Neuroprotectief
- 3.4 Perifere zenuwstelsel
- 3.5 Celdood
- 3.6 Langetermijngeheugen
- 3.7 Stamcelvernieuwing
- 4 Ziekten veroorzaakt door prionen
- 4.1 Ziekte van Creutzfeldt-Jakob (CJD)
- 4.2 Ziekte van Gerstmann-Sträussler-Scheinker
- 4.3 Prionopathie met variabele proteasegevoeligheid
- 4.4 Dodelijke slapeloosheid
- 4,5 Kuru
- 4.6 Ziekten bij dieren
- 5 behandelingen
- 6 Preventie
- 7 referenties
Algemene karakteristieken
Prionen zijn eiwitstructuren die aanwezig zijn in celmembranen. Deze eiwitten hebben een veranderde vorm of conformatie [PrP (Sc)].
Wat de vermenigvuldiging betreft, wordt dit bereikt door de omzetting van vormen, zoals in het geval van de scrapieziekte. Bij deze ziekte rekruteren prionen PrP (C) (prioneiwitten met ongewijzigde conformatie) om de omzetting naar de PrP (Sc) -isovorm te stimuleren..
Dit wekt een kettingreactie op die het besmettelijke materiaal verspreidt en daardoor de ziekte kan worden geïrrigeerd. Het is nog niet bekend hoe dit conversieproces verloopt.
Deze ongebruikelijke eiwitten die zich kunnen voortplanten, hebben geen nucleïnezuren. Het bewijs hiervan is dat ze bestand zijn tegen röntgenstraling en ultraviolette straling. Deze middelen breken nucleïnezuren gemakkelijk af.
Prioneiwitten, waarvan prionen (PrP) zijn samengesteld, worden door het hele lichaam aangetroffen, niet alleen bij mensen maar ook bij andere gezonde gewervelde dieren. Deze eiwitten zijn over het algemeen resistent tegen proteasen (enzymen die eiwitten katalyseren).
Er is zeer weinig bekend over het nut van de prioneiwitten PrP (C), de normale vorm van het niet-infectieuze eiwit in het menselijk lichaam..
Sommige onderzoekers zijn er echter in geslaagd aan te tonen dat deze eiwitten bij muizen het myelineherstel in cellen van het perifere zenuwstelsel activeren. Het is ook aangetoond dat de afwezigheid hiervan demyelinisatie van dergelijke zenuwcellen veroorzaakt..
Structuren
De kennis die men heeft over de structuur van prionen zit vooral in de onderzoeken die in de bacterie worden uitgevoerd Escherichia coli.
Studies hebben aangetoond dat de ketenpolypeptiden PrP (C) (normaal) en PrP (Sc) (infectieus) identiek zijn in aminozuursamenstelling, maar verschillen in hun 3D-conformatie en vouwing..
PrP (C)
Deze niet-infectieuze prionen hebben bij de mens 209 aminozuren. Ze hebben een disulfidebinding. De structuur is alfa-helix, wat betekent dat het spiraalvormige aminozuren (alfa-helices) en enkele platte strengen aminozuren (bètavellen) heeft..
Dit eiwit kan niet worden afgescheiden door centrifugeren, wat inhoudt dat het niet bezinkbaar is. Het wordt gemakkelijk verteerd door het breedspectrum serineprotease genaamd proteïnase K.
PrP (Sc)
Het is een infectieus eiwit dat PrP (C) omzet in infectieuze PrP (Sc) -isovormen en met een abnormale configuratie of vorm.
Er is zeer weinig bekend over de 3D-structuur, maar het is bekend dat het weinig spiraalvormige vormen heeft en meer platte strengen of bètavellen. De verschuiving naar de isovorm is wat bekend staat als de cruciale gebeurtenis van prionziekten.
Kenmerken
Cellulaire prioneiwitten [Prp (C)] bevinden zich op het celoppervlak van een grote verscheidenheid aan organen en weefsels. Er is zeer weinig bekend over de fysiologische functies van prionen in het lichaam. Toch duiden experimenten bij muizen op mogelijke functies, zoals:
Met metabotrope glutamaatreceptoren
Van PrP (C) is aangetoond dat het werkt met glutamaatreceptoren (ionotroop en metabotroop). PrP (C) neemt deel als een receptor voor synaptotoxische oligomeren van het celoppervlak peptide Aβ.
In embryonale ontwikkeling
Bij muizen van de Murinae-familie is ontdekt dat de prioneiwitten PrP (C) binnen enkele dagen na implantatie tot expressie worden gebracht, in de embryonale ontwikkeling..
Dit geeft aan dat ze een rol spelen bij de ontwikkeling van deze kleine zoogdieren. Rol die volgens de onderzoekers verband houdt met de regulatie van neuritogenese (productie van axonen en dendrieten van neuronen).
Ze werken ook op axonale groei. Deze prioneiwitten zijn zelfs betrokken bij de ontwikkeling van het cerebellaire circuit. Hierdoor wordt aangenomen dat de afwezigheid van deze PrP (C) -prionen een vertraging in de motorische ontwikkeling van knaagdieren met zich meebrengt..
Neuroprotectief
In onderzoeken naar de overexpressie van PrP (C) door genoriëntatie, werd gevonden dat de afwezigheid van deze prionen problemen veroorzaakt met de bloedtoevoer naar sommige delen van de hersenen (acute cerebrale ischemie)..
Dit betekent dat prioneiwitten functioneren als neuroprotectors. Bovendien is aangetoond dat overexpressie van PrP (C) verwondingen veroorzaakt door ischemie kan verminderen of verbeteren..
Perifere zenuwstelsel
De fysiologische rol van Prp (C) bij de instandhouding van perifere myeline is onlangs ontdekt.
Tijdens een laboratoriumstudie werd ontdekt dat laboratoriummuizen bij afwezigheid van het prioneiwit tekorten ontwikkelden in de zenuwen die informatie uit de hersenen en het ruggenmerg vervoeren, in wat een perifere neuropathie wordt genoemd..
Celdood
Sommige eiwitten lijken op prionen en deze bevinden zich in andere delen van het lichaam dan in de hersenen.
De functies van dergelijke eiwitten zijn het initiëren, reguleren en / of controleren van celdood, wanneer het organisme wordt aangevallen (bijvoorbeeld door virons), waardoor de verspreiding van de ziekteverwekker wordt voorkomen..
Deze eigenaardige functie van deze eiwitten zet onderzoekers aan het denken over het mogelijke belang van niet-infectieuze prionen in de strijd tegen ziekteverwekkers..
Lange termijn geheugen
Een studie uitgevoerd aan het Stowers Institute in Missouri, VS, toonde aan dat PrP-prionen een rol kunnen spelen bij het behoud van het langetermijngeheugen.
De studie onthulde dat bepaalde prioneiwitten kunnen worden gecontroleerd om te werken bij het handhaven van de fysiologische functies van het langetermijngeheugen..
Stamcelvernieuwing
Een onderzoek naar prioneiwitten die tot expressie komen in stamcellen van bloedweefsel, toonde aan dat al deze stamcellen (hematopoietische) prioneiwitten tot expressie brengen in hun celmembraan. Voor wat wordt aangenomen dat ze deelnemen aan het complexe en zeer belangrijke proces van celvernieuwing.
Prionziekten
Pathologieën van prionoorsprong worden erkend als progressieve degeneratieve hersenaandoeningen. Ze kunnen vee, herten, kariboes, schapen en zelfs mensen aanvallen.
Deze ziekten worden veroorzaakt door een verandering in de structuur van de PrP (C) -eiwitten en waarvan de specifieke functies vandaag de dag nog onzeker zijn. Prionpathologieën kunnen optreden zonder een bekende oorzaak. Ze kunnen een erfelijke genetische oorsprong hebben en kunnen ook op een infectieus-besmettelijke manier worden overgedragen.
Prionen veroorzaken familiale, sporadische en besmettelijke ziekten. Familiale prionziekten zijn erfelijke ziekten. Sporadische pathologieën zijn de meest voorkomende en komen voor zonder bekende oorzaken..
Besmettelijke ziekten worden als zeldzaam beschouwd, ze worden overgedragen van persoon op persoon, dier op dier, persoon op dier en vice versa. De oorzaken zijn talrijk en variëren van consumptie van besmet vlees, kannibalisme, transfusies tot manipulatie van besmet chirurgisch materiaal.
De meest voorkomende prionziekten zijn:
Ziekte van Creutzfeldt-Jakob (CJD)
Beschouwd als de meest voorkomende prionziekte bij mensen, is het een kosmopolitische ziekte, dat wil zeggen, het heeft een wereldwijde verspreiding. Het kan erfelijk (familiaal), sporadisch of besmettelijk zijn.
Patiënten vertonen symptomen zoals dementie, schokken of plotselinge onvrijwillige bewegingen en gebreken aan het centrale zenuwstelsel.
Afhankelijk van de behandeling en vorm van de ziekte kan de dood optreden tussen 4 maanden en 2 jaar na het oplopen van de ziekte. Diagnose is moeilijk te stellen, het wordt meestal gedaan post morten, tijdens autopsie.
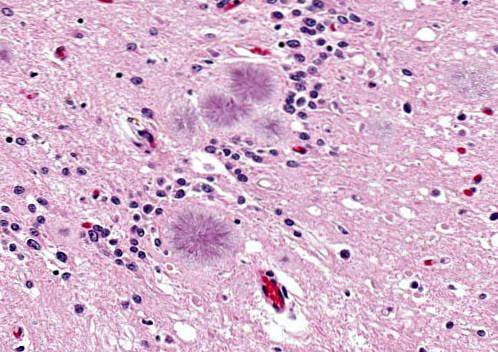
Ziekte van Gerstmann-Sträussler-Scheinker
Het is een ziekte die wordt veroorzaakt door prionen in een erfelijk of autosomaal dominant infectieus hersenproces. De ziekte manifesteert zich bij mensen van 40 tot 60 jaar.
Deze mensen vertonen problemen om woorden te verwoorden (dysartrie), schokken of plotselinge onvrijwillige bewegingen, agressiviteit komt vaak voor.
Ze presenteren zich met cerebellaire degeneratie die gepaard gaat met een onstabiele manier van lopen. Het is ook mogelijk om onder andere hyporeflexie, doofheid, blikverlamming, dementie waar te nemen. De levensverwachting is ongeveer 5 jaar of iets langer.
Prionopathie met variabele gevoeligheid voor protease
Het is een zeer zeldzame ziekte, tot op het punt dat het aantal gevallen van 2 tot 3 gevallen per 100 miljoen inwoners bedraagt. De pathologie is vergelijkbaar met de ziekte van Gerstmann-Sträussler-Scheinker.
De klinische manifestaties van het eiwit duiden op een lage resistentie tegen proteasen, sommige zijn meer en andere minder gevoelig voor deze enzymen.
De symptomen die patiënten vertonen zijn: problemen met spraak en cognitieve stoornissen, verlies van neuronen in het gebied waar de hersenen bewegingen controleren en spiercoördinatie uitvoeren.
De ziekte komt vaak voor bij oudere patiënten (70 jaar) en de geschatte levensduur na infectie is ongeveer 20 maanden.
Fatale slapeloosheid
Het is een erfelijke of familiaire ziekte, het kan ook sporadisch voorkomen. Het is bekend dat de ziekte het gevolg is van een erfelijke of autosomaal dominante mutatie.
Patiënten vertonen symptomen zoals cumulatieve problemen met slapen en slapen, dementie, cognitieve stoornissen, zelfs problemen met hypertensie, tachycardie, hyperhidrose en andere..
De leeftijd die het beïnvloedt is vrij breed, variërend tussen 23 en 73 jaar, maar de gemiddelde leeftijd is 40 jaar. De levensduur na besmetting is iets meer dan 6 jaar.
Kuru
Deze prionziekte is alleen vastgesteld bij de inwoners van Papoea-Nieuw-Guinea. Het is een ziekte die verband houdt met kannibalisme en de culturele traditie van de rite van rouw om de doden, waarbij deze mensen hersenen of mensenvlees eten.
Mensen die de ziekte dragen, hebben meestal oncontroleerbare en onvrijwillige bewegingen in verschillende delen van het lichaam.
Ze vertonen trillingen, verlies van controle over bewegingen en verlies van spiercoördinatie. De levensverwachting bij geïnfecteerde mensen is twee jaar.
Ziekten bij dieren
Een van de pathologieën die door prionen bij dieren worden geproduceerd, is boviene spongiforme encefalopathie. Deze ziekte veroorzaakte grote schade in Europa, in de volksgezondheid, die van dieren en in de economie van de getroffen landen.
Andere ziekten bij dieren zijn scrapie, overdraagbare nertsencefalopathie, chronische afvalziekte (bij herten) en katachtige spongiforme encefalopathie..
Deze ziekten, zoals die bij mensen voorkomen, missen een effectieve behandeling, dus preventie is essentieel, vooral na infecties bij mensen die zijn opgetreden als gevolg van de consumptie van vlees van geïnfecteerde koeien..
Behandelingen
Tot op heden is er geen remedie bekend voor prionziekten. De behandeling is symptomatisch. Patiënten wordt geadviseerd om palliatieve zorg en genetische tests te plannen en advies voor familieleden wordt aanbevolen.
Een grote verscheidenheid aan medicijnen is getest bij patiënten met prionziekten, zoals antivirale middelen, antitumoren, geneesmiddelen voor ziekten zoals Parkinson, behandelingen voor immunosuppressie, antibiotica, antischimmelmiddelen en zelfs antidepressiva..
Er zijn momenteel echter geen aanwijzingen dat sommige van deze symptomen de symptomen verminderen of de overleving van patiënten verbeteren..
Preventie
Prionen zijn bestand tegen allerlei fysische en chemische veranderingen. Er worden echter verschillende technieken gebruikt om besmetting van patiënten met besmette chirurgische instrumenten te voorkomen..
Een van de meest gebruikte technieken is om de apparatuur gedurende één uur in een autoclaaf bij 132 ° C te steriliseren en vervolgens de instrumenten gedurende minstens één uur in natriumhydroxide onder te dompelen..
Aan de andere kant heeft de wereldgezondheidsorganisatie (WHO) maatregelen ontwikkeld om de verspreiding van prionziekten te voorkomen. Deze organisatie stelt normen vast voor het hanteren van verboden of potentieel risicovolle weefsels zoals: ogen, hersenen, darmen, amandelen en ruggenmerg.
Referenties
- Prion, besmettelijke agent. Opgehaald van britannica.com.
- Wat is een prion? Opgehaald van Scientificamerican.com.
- P.C. Kalikiri, R.G. Sachan. 2003. Prionen - Eiwitachtige infectieuze deeltjes. Tijdschrift, Indian Academy of Clinical Medicine.
- Prion. Opgehaald van en.wikipedia.org
- K.M. Pan, M. Baldwin, J. Nguyen, M. Gasset, A. Serban, D. Groth, I. Mehlhorn, Z. Huang, R.J. Fletterick, F.E. Cohen (1993). Omzetting van alfa-helices in bètavellen speelt een rol bij de vorming van de scrapie-prioneiwitten. Proceedings of the National Academy of Sciences van de Verenigde Staten van Amerika.
- M.-A. Wulf, A. Senatore en A. Aguzzic (2017). De biologische functie van het cellulaire prioneiwit: een update. BCM Biology.
- DC Zhang, A.D. Steele, S. Lindquist, H.F. Lodish (2006). Prioneiwit wordt tot expressie gebracht op langdurige herbevolking van hematopoëtische stamcellen en is belangrijk voor hun zelfvernieuwing. Proceedings of the National Academy of Sciences van de Verenigde Staten van Amerika.
- Overzicht van prionziekten (overdraagbare spongiforme encefalopathieën) Teruggeplaatst van msdmanuals.com.
- E. Arranz-Martínez, G. Trillo-Sánchez-Redondo, A. Ruiz-García, S. Ares-Blanco (2010). Prionpathieën: prionencefalopathieën. Familie medicijn. SEMERGEN.



Niemand heeft nog op dit artikel gereageerd.