
Wat is de reactiewarmte?

De reactiewarmte of enthalpie van reactie (ΔH) is de verandering in enthalpie van een chemische reactie die optreedt bij constante druk. Het is een thermodynamische maateenheid die nuttig is om de hoeveelheid energie per mol te berekenen die vrijkomt of geproduceerd wordt bij een reactie.
Omdat enthalpie is afgeleid van druk, volume en interne energie, die allemaal toestandsfuncties zijn, is enthalpie ook een toestandsfunctie..
ΔH, of de enthalpie-verandering kwam naar voren als een meeteenheid die bedoeld was om de energieverandering van een systeem te berekenen toen het te moeilijk werd om de ΔU te vinden, of verandering in de interne energie van een systeem, waarbij tegelijkertijd de hoeveelheid warmte en uitgewisseld werk werd gemeten.
Gegeven een constante druk, is de enthalpie-verandering gelijk aan warmte en kan worden gemeten als ΔH = q.
De notatie ΔHº of ΔHºr dan ontstaat om de precieze temperatuur en druk van de reactiewarmte ΔH te verklaren.
De standaard reactie-enthalpie wordt gesymboliseerd door ΔHº of ΔHºrxn en kan zowel positieve als negatieve waarden aannemen. De eenheden voor ΔHº zijn kiloJoules per mol, of kj / mol.
Vorig concept om de reactiewarmte te begrijpen: verschillen tussen ΔH en ΔHºr.
Δ = vertegenwoordigt de verandering in enthalpie (enthalpie van producten minus enthalpie van reactanten).
Een positieve waarde geeft aan dat de producten een hogere enthalpie hebben, of dat het een endotherme reactie is (warmte is vereist).
Een negatieve waarde geeft aan dat de reactanten een hogere enthalpie hebben, of dat het een exotherme reactie is (er wordt warmte geproduceerd).
º = betekent dat de reactie een standaard enthalpie-verandering is, en plaatsvindt bij een vooraf ingestelde druk / temperatuur.
r = geeft aan dat deze verandering de enthalpie van de reactie is.
De standaardtoestand: de standaardtoestand van een vaste stof of vloeistof is de zuivere stof bij een druk van 1 bar of wat is dezelfde 1 atmosfeer (105 Pa) en een temperatuur van 25 ° C, of wat is dezelfde 298 K.
De ΔHºr is de standaard reactiewarmte of standaard enthalpie van een reactie, en als ΔH meet het ook de enthalpie van een reactie. ΔHºrxn vindt echter plaats onder “standaard” omstandigheden, wat betekent dat de reactie plaatsvindt bij 25º C en 1 atm..
Het voordeel van een ΔH-meting onder standaardomstandigheden ligt in het vermogen om de ene ΔHº-waarde aan de andere te relateren, aangezien ze onder dezelfde omstandigheden voorkomen.
Warmte van vorming
De standaardvormingswarmte, ΔHF.º, van een chemisch product is de hoeveelheid warmte die wordt geabsorbeerd of vrijgegeven door de vorming van 1 mol van die chemische stof bij 25 graden Celsius en 1 bar van zijn elementen in hun standaardtoestanden.
Een element bevindt zich in zijn standaardtoestand als het in zijn meest stabiele vorm is en zijn fysische toestand (vast, vloeibaar of gas) bij 25 graden Celsius en 1 bar.
Bij de standaardvormingswarmte voor kooldioxide zijn bijvoorbeeld zuurstof en koolstof als reactanten betrokken..
Zuurstof is stabieler als O-gasmoleculentwee, terwijl koolstof stabieler is dan vast grafiet. (Grafiet is stabieler dan diamant onder standaardomstandigheden).
Om de definitie op een andere manier uit te drukken: de standaardvormingswarmte is een speciaal type standaardreactiewarmte..
De reactie is de vorming van 1 mol van een chemische stof uit de elementen in hun standaardtoestanden onder standaardomstandigheden.
De standaardvormingswarmte wordt ook wel de standaardvormingsenthalpie genoemd (hoewel het eigenlijk een verandering in enthalpie is).
Per definitie zou de vorming van een element op zichzelf geen verandering in enthalpie veroorzaken, dus de standaard reactiewarmte voor alle elementen is nul (Cai, 2014).
Berekening van de reactie-enthalpie
1- Experimentele berekening
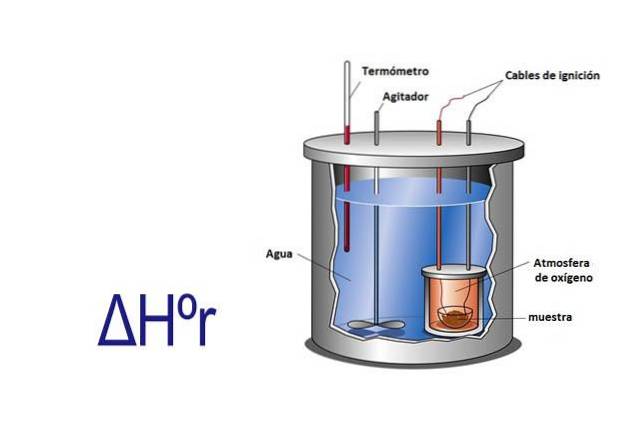
Enthalpie kan experimenteel worden gemeten met behulp van een calorimeter. Een calorimeter is een instrument waarbij een monster reageert via elektrische kabels die de activeringsenergie leveren. Het monster bevindt zich in een container omgeven door water dat constant wordt geroerd.
Door te meten met a de verandering in temperatuur die optreedt wanneer het monster reageert, en door de soortelijke warmte van water en zijn massa te kennen, wordt de warmte die vrijkomt of geabsorbeerd door de reactie berekend met behulp van de vergelijking q = Cesp x m x ΔT.
In deze vergelijking is q warmte, Cesp is in dit geval de soortelijke warmte van water die gelijk is aan 1 calorie per gram, m is de massa van water en ΔT is de verandering in temperatuur.
De calorimeter is een geïsoleerd systeem met een constante druk, dus ΔHr= q
2- Theoretische berekening
De enthalpie-verandering is niet afhankelijk van het specifieke pad van een reactie, maar alleen van het globale energieniveau van de producten en reactanten. Enthalpie is een functie van de staat, en als zodanig is het additief.
Om de standaardenthalpie van een reactie te berekenen, kunnen we de standaardvormingsenthalpie van de reactanten optellen en deze aftrekken van de som van de standaardvormingsenthalpie van de producten (Boundless, S.F.). Wiskundig gezegd, geeft dit ons:
AHr° = Σ ΔHF.º (producten) - Σ ΔHF.º (reactanten).
Enthalpieën van reacties worden meestal berekend uit enthalpie van reactantvorming onder normale omstandigheden (druk van 1 bar en temperatuur 25 graden Celsius).
Om dit principe van thermodynamica uit te leggen, zullen we de enthalpie van de reactie voor de verbranding van methaan (CH4) volgens de formule:
CH4 (g) + 2Otwee (g) → COtwee (g) + 2HtweeO (g)
Om de standaardenthalpie van de reactie te berekenen, moeten we de standaardvormingsenthalpie vinden voor elk van de reactanten en producten die bij de reactie betrokken zijn..
Deze zijn meestal te vinden in een bijlage of in verschillende tabellen online. Voor deze reactie zijn de gegevens die we nodig hebben:
H.F.º CH4 (g) = -75 kjoul / mol.
H.F.º Otwee (g) = 0 kjoul / mol.
H.F.º COtwee (g) = -394 kjoul / mol.
H.F.º HtweeO (g) = -284 kjoul / mol.
Merk op dat omdat het zich in de standaardtoestand bevindt, de standaardvormingsenthalpie voor zuurstofgas 0 kJ / mol is.
Hier vatten we onze standaard vormingsenthalpie samen. Merk op dat omdat de eenheden in kJ / mol zijn, we moeten vermenigvuldigen met de stoichiometrische coëfficiënten in de gebalanceerde reactievergelijking (Leaf Group Ltd, S.F.).
Σ ΔHF.º (producten) = ΔHF.º COtwee +2 AHF.º HtweeOF
A ΔHF.º (producten) = -1 (394 kjoul / mol) -2 (284 kjoul / mol) = -962 kjoul / mol
Σ ΔHF.º (reactanten) = ΔHF.º CH4 + AHF.º Otwee
Σ ΔHF.º (reactanten) = -75 kjoul / mol + 2 (0 kjoul / mol) = -75 kjoul / mol
Nu kunnen we de standaardenthalpie van de reactie vinden:
AHr° = Σ ΔHF.º (producten) - Σ ΔHF.º (reactanten) = (- 962) - (- 75) =
AHr = - 887kJ / mol.
Referenties
- Anne Marie Helmenstine. (2014, 11 juni). Enthalpie van reactiedefinitie. Hersteld van thoughtco: thoughtco.com.
- (S.F.). Standard Enthalpy of Reaction. Hersteld van grenzeloos: boundless.com.
- Cai, E. (2014, 11 maart). standaard vormingswarmte. Opgehaald van chemicalstatistician: chemicalstatistician.wordpress.com.
- Clark, J. (2013, mei). Verschillende definities van enthalpie-verandering. Opgehaald van chemguide.co.uk: chemguide.co.uk.
- Jonathan Nguyen, G. L. (2017, 9 februari). Standard Enthalpy of Formation. Opgehaald van chem.libretexts.org: chem.libretexts.org.
- Leaf Group Ltd. (S.F.). Hoe enthalpie van reactie te berekenen. Hersteld van sciencing: sciencing.com.
- Rachel Martin, E. Y. (2014, 7 mei). Warmte van reactie. Opgehaald van chem.libretexts.org: chem.libretexts.org.


Niemand heeft nog op dit artikel gereageerd.