
Wat is de externe elektronenconfiguratie?

De elektronische configuratie, Ook wel elektronische structuur genoemd, het is de rangschikking van elektronen in energieniveaus rond een atoomkern. Volgens het oude atoommodel van Bohr bezetten elektronen verschillende niveaus in banen rond de kern, van de eerste schaal die zich het dichtst bij de kern bevindt, K, tot de zevende schaal, Q, die het verst van de kern verwijderd is..
In termen van een meer verfijnd kwantummechanisch model, zijn de K-Q-schalen onderverdeeld in een reeks orbitalen, die elk kunnen worden bezet door niet meer dan één paar elektronen..
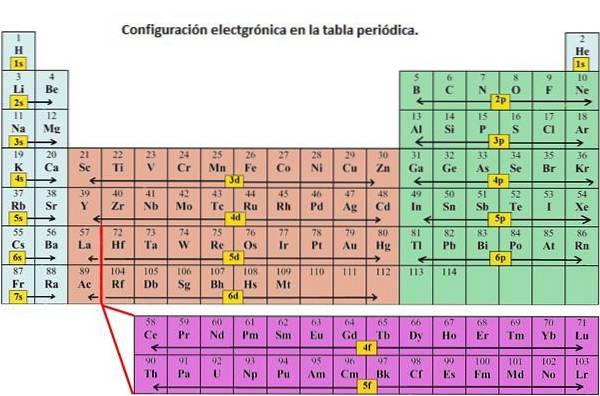
Gewoonlijk wordt de elektronenconfiguratie gebruikt om de orbitalen van een atoom in zijn grondtoestand te beschrijven, maar het kan ook worden gebruikt om een atoom weer te geven dat is geïoniseerd tot een kation of anion, waarmee het verlies of de toename van elektronen in hun respectieve orbitalen wordt gecompenseerd. ..
Veel van de fysische en chemische eigenschappen van elementen kunnen worden gecorreleerd met hun unieke elektronische configuraties. Valentie-elektronen, de elektronen in de buitenste schil, zijn de bepalende factor voor de unieke chemie van het element..
Basisprincipes van elektronenconfiguraties
Voordat de elektronen van een atoom aan orbitalen worden toegewezen, moet men zich vertrouwd maken met de basisprincipes van elektronenconfiguraties. Elk element in het periodiek systeem bestaat uit atomen, die zijn opgebouwd uit protonen, neutronen en elektronen..
Elektronen vertonen een negatieve lading en worden gevonden rond de kern van het atoom in de orbitalen van het elektron, gedefinieerd als het volume van de ruimte waarin het elektron zich binnen een waarschijnlijkheid van 95% bevindt..
De vier verschillende soorten orbitalen (s, p, d en f) hebben verschillende vormen en één orbitaal kan maximaal twee elektronen bevatten. De p-, d- en f-orbitalen hebben verschillende subniveaus, zodat ze meer elektronen kunnen bevatten.
Zoals aangegeven, is de elektronenconfiguratie van elk element uniek voor zijn positie in het periodiek systeem. Het energieniveau wordt bepaald door de periode en het aantal elektronen wordt bepaald door het atoomnummer van het element.
Orbitalen op verschillende energieniveaus lijken op elkaar, maar bezetten verschillende gebieden in de ruimte..
De 1s-orbitaal en de 2s-orbitaal hebben de kenmerken van een s-orbitaal (radiale knooppunten, waarschijnlijkheden van sferisch volume, ze kunnen maar twee elektronen bevatten, enz.). Maar omdat ze zich op verschillende energieniveaus bevinden, bezetten ze verschillende ruimtes rond de kern. Elke orbitaal kan worden weergegeven door specifieke blokken op het periodiek systeem..
Blok s is het gebied van alkalimetalen inclusief helium (groepen 1 en 2), blok d is de overgangsmetalen (groepen 3 tot 12), blok p is de elementen van de hoofdgroep van groepen 13 tot 18, en het f-blok zijn de lanthanide- en actinide-reeks.

Aufbau-principe
Aufbau komt van het Duitse woord "Aufbauen" wat "bouwen" betekent. Door elektronenconfiguraties te schrijven, bouwen we in wezen elektronenorbitalen terwijl we van het ene atoom naar het andere gaan..
Terwijl we de elektronenconfiguratie van een atoom schrijven, vullen we de orbitalen in oplopende volgorde van atoomnummer.
Het Aufbau-principe komt voort uit het Pauli-uitsluitingsprincipe dat zegt dat er geen twee fermionen (bijv. Elektronen) in een atoom zitten. Ze kunnen dezelfde reeks kwantumgetallen hebben, dus moeten ze "stapelen" op hogere energieniveaus.
Hoe elektronen zich ophopen is een onderwerp van elektronenconfiguraties (Aufbau Principle, 2015).
Stabiele atomen hebben evenveel elektronen als protonen in de kern. Elektronen verzamelen zich rond de kern in kwantumorbitalen volgens vier basisregels die het Aufbau-principe worden genoemd..
- Er zijn geen twee elektronen in het atoom die dezelfde vier kwantumgetallen n, l, m en s delen.
- Elektronen zullen eerst de orbitalen van het laagste energieniveau innemen.
- De elektronen vullen de orbitalen altijd met hetzelfde spinnummer. Als de orbitalen vol zijn, begint het.
- De elektronen vullen orbitalen met de som van de kwantumgetallen n en l. Orbitalen met gelijke waarden van (n + l) worden eerst gevuld met de lagere n-waarden.
De tweede en vierde regel zijn in principe hetzelfde. Een voorbeeld van regel vier zijn de 2p- en 3s-orbitalen.
Een 2p-orbitaal is n = 2 en l = 2 en een 3s-orbitaal is n = 3 en l = 1. (N + l) = 4 in beide gevallen, maar de 2p-orbitaal heeft de laagste energie of de laagste n-waarde en zal vul voor de laag 3s.
Gelukkig kan het Moeller-diagram in figuur 2 worden gebruikt om elektronenvulling te doen. De grafiek wordt gelezen door de diagonalen vanaf 1s te laten lopen.
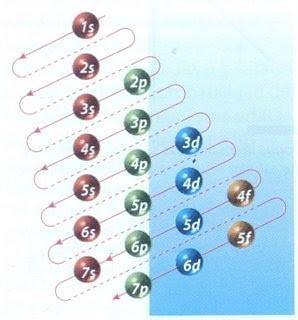
Figuur 2 toont de atomaire orbitalen en de pijlen volgen de weg voorwaarts.
Nu bekend is dat de volgorde van de orbitalen is gevuld, is het enige dat overblijft, de grootte van elke orbitaal te onthouden.
S-orbitalen hebben 1 mogelijke waarde van ml om 2 elektronen vast te houden
P-orbitalen hebben 3 mogelijke waarden van ml om 6 elektronen vast te houden
D-orbitalen hebben 5 mogelijke waarden van ml om 10 elektronen vast te houden
F-orbitalen hebben 7 mogelijke waarden van ml om 14 elektronen vast te houden
Dit is alles wat nodig is om de elektronische configuratie van een stabiel atoom van een element te bepalen..
Neem bijvoorbeeld het element stikstof. Stikstof heeft zeven protonen en dus zeven elektronen. De eerste orbitaal die moet worden gevuld, is de 1s-orbitaal.
Een s-orbitaal heeft twee elektronen, dus er zijn nog vijf elektronen over. De volgende orbitaal is de 2s-orbitaal en bevat de volgende twee. De laatste drie elektronen gaan naar de 2p-orbitaal die maximaal zes elektronen kan bevatten (Helmenstine, 2017).
Belang van externe elektronenconfiguratie
Elektronenconfiguraties spelen een belangrijke rol bij het bepalen van de eigenschappen van atomen.
Alle atomen van dezelfde groep hebben dezelfde externe elektronische configuratie met uitzondering van het atoomnummer n, daarom hebben ze vergelijkbare chemische eigenschappen.
Enkele van de belangrijkste factoren die atomaire eigenschappen beïnvloeden, zijn onder meer de grootte van de grootste bezette orbitalen, de energie van de hoger-energetische orbitalen, het aantal orbitale vacatures en het aantal elektronen in de hoger-energetische orbitalen..
De meeste atomaire eigenschappen kunnen worden gerelateerd aan de mate van aantrekking tussen de buitenste elektronen naar de kern en het aantal elektronen in de buitenste elektronenschil, het aantal valentie-elektronen..
De elektronen van de buitenste schil zijn degenen die covalente chemische bindingen kunnen vormen, zij zijn degenen die het vermogen hebben om te ioniseren om kationen of anionen te vormen en zij zijn degenen die de oxidatietoestand aan de chemische elementen geven..
Ze bepalen ook de atoomstraal. Naarmate n groter wordt, neemt de atoomstraal toe. Wanneer een atoom een elektron verliest, zal er een samentrekking van de atoomstraal zijn als gevolg van de afname van de negatieve lading rond de kern..
De elektronen van de buitenste schil zijn die waarmee rekening wordt gehouden door de valentiebindingstheorie, kristallijne veldentheorie en moleculaire orbitaaltheorie om de eigenschappen van de moleculen en de hybridisaties van de bindingen te verkrijgen..
Referenties
- Aufbau-principe. (2015, 3 juni). Opgehaald van chem.libretexts: chem.libretexts.org.
- Bozeman Science. (2013, uitgeput 4). Elektronen configuratie. Genomen van youtube: youtube.com.
- Elektronenconfiguraties en de eigenschappen van atomen. (S.F.). Genomen uit oneonta.edu: oneonta.edu.
- Encyclopædia Britannica. (2011, 7 september). Elektronische configuratie. Ontleend aan britannica: britannica.com.
- Faizi, S. (2016, 12 juli). Elektronische configuraties. Ontleend aan chem.libretexts: chem.libretexts.org.
- Helmenstine, T. (2017, 7 maart). Het Aufbau-principe - elektronische structuur en het Aufbau-principe. Ontleend aan thoughtco: thoughtco.com.
- Khan, S. (2014, 8 juni). Valentie-elektronen en binding. Ontleend aan khanacademy: khanacademy.org.



Niemand heeft nog op dit artikel gereageerd.