
Wat is een verdunde oplossing? factoren en voorbeelden
EEN verdunde oplossing of onverzadigdHet is een chemische oplossing die de maximale concentratie opgeloste stof in een oplosmiddel niet heeft bereikt. De extra opgeloste stof zal oplossen wanneer deze wordt toegevoegd aan een verdunde oplossing en zal niet verschijnen in de waterfase..
Vanuit fysisch-chemisch oogpunt wordt een onverzadigde oplossing beschouwd als een toestand van dynamisch evenwicht waarin de snelheid waarmee het oplosmiddel de opgeloste stof oplost groter is dan de herkristallisatiesnelheid..
Een voorbeeld van een verdunde oplossing wordt geïllustreerd in figuur 1. In figuur 1.1, 1.2 en 1.3 is er een constant volume water in de beker.
In figuur 1.1 begint het proces waar de opgeloste stof begint op te lossen, weergegeven door de rode pijlen. In dit geval worden twee fasen gezien, een vloeistof en een vaste stof.
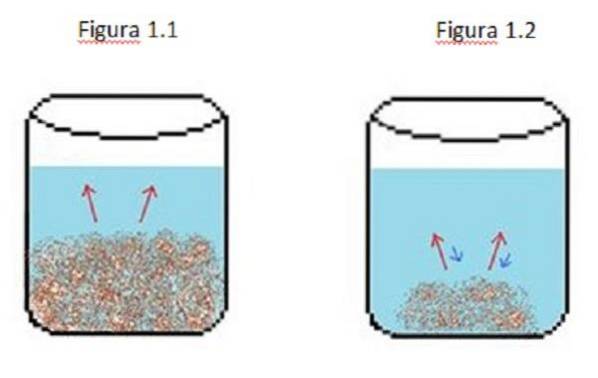
In figuur 1.2 is veel van de vaste stof opgelost, maar niet volledig als gevolg van het herkristallisatieproces, weergegeven door de blauwe pijlen..
In dit geval zijn de rode pijlen groter dan de blauwe pijlen, wat betekent dat de verdunningssnelheid groter is dan de herkristallisatiesnelheid. Op dit punt heb je een onverzadigde oplossing.
We kunnen dus zeggen dat een verdunde oplossing er meer opgeloste stof in kan oplossen totdat het het verzadigingspunt bereikt. Op het verzadigingspunt lost geen opgeloste stof meer op in het oplosmiddel en een dergelijke oplossing wordt een verzadigde oplossing genoemd..
Op deze manier zijn de oplossingen aanvankelijk onverzadigd van aard en worden uiteindelijk verzadigde oplossingen door de toevoeging van opgeloste stof erin..
Wat is een verdunde oplossing?
Een verdunde oplossing is die onverzadigde, verzadigde of oververzadigde oplossing waaraan meer oplosmiddel is toegevoegd. Het resultaat is een onverzadigde oplossing met een lagere concentratie.
Verdunningen zijn een veelvoorkomend proces in een chemisch laboratorium. Over het algemeen werk je met verdunde oplossingen die zijn gemaakt van voorraadoplossingen die rechtstreeks bij een bepaalde handelaar worden gekocht.
Om de verdunningen te maken, wordt de formule C gebruikt1V.1= CtweeV.twee waarbij C de concentratie van de oplossing is, meestal in termen van molariteit of normaliteit. V is het volume van de oplossing in ml en termen 1 en 2 komen overeen met respectievelijk de geconcentreerde en verdunde oplossingen.
Factoren die de oplosbaarheid beïnvloeden
De hoeveelheid opgeloste stof die in een oplosmiddel kan worden opgelost, is afhankelijk van verschillende factoren, waarvan de belangrijkste zijn:
1- Temperatuur
Oplosbaarheid neemt toe met temperatuur. In heet water kan bijvoorbeeld meer zout worden opgelost dan in koud water..
Er kunnen echter uitzonderingen zijn, bijvoorbeeld de oplosbaarheid van gassen in water neemt af met toenemende temperatuur..
In dit geval ontvangen de opgeloste moleculen kinetische energie terwijl ze opwarmen, wat hun ontsnapping vergemakkelijkt..
2- Druk
Verhoogde druk kan het oplossen van opgeloste stoffen forceren. Dit wordt vaak gebruikt om gassen in vloeistoffen op te lossen..
3- Chemische samenstelling
De aard van de opgeloste stof en het oplosmiddel en de aanwezigheid van andere chemische verbindingen in de oplossing beïnvloeden de oplosbaarheid..
In water kan bijvoorbeeld meer suiker worden opgelost dan zout in water. In dit geval wordt gezegd dat suiker beter oplosbaar is.
Ethanol en water zijn volledig met elkaar oplosbaar. In dit specifieke geval is het oplosmiddel de verbinding die in de grootste hoeveelheid wordt aangetroffen.
4- Mechanische factoren
In tegenstelling tot de oplossnelheid, die voornamelijk afhangt van de temperatuur, hangt de herkristallisatiesnelheid af van de opgeloste stofconcentratie op het oppervlak van het kristalrooster, wat de voorkeur heeft wanneer een oplossing onbeweeglijk is.
Daarom voorkomt agitatie van de oplossing deze accumulatie, waardoor het oplossen wordt gemaximaliseerd..
Verzadiging en oplosbaarheidscurves
De oplosbaarheidscurves zijn een grafische database waarin de hoeveelheid opgeloste stof die oplost in een hoeveelheid oplosmiddel wordt vergeleken, bij een bepaalde temperatuur.
Oplosbaarheidscurves worden gewoonlijk uitgezet voor een hoeveelheid opgeloste stof, hetzij vast of gas, in 100 gram water. Verzadigingskrommen voor verschillende opgeloste stoffen in water worden geïllustreerd in Figuur 2..
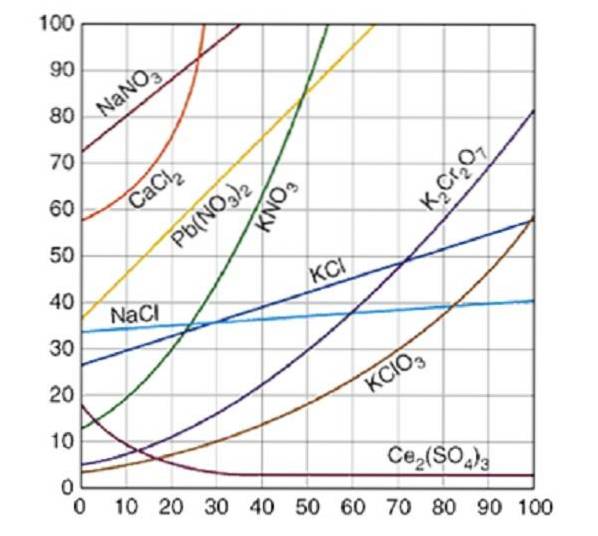
De curve geeft het verzadigingspunt aan bij een bepaalde temperatuur. Het gebied onder de curve geeft aan dat u een onverzadigde oplossing heeft en dat er daarom meer opgeloste stof kan worden toegevoegd. In het gebied boven de curve bevindt zich een oververzadigde oplossing.
Als we natriumchloride (NaCl) als voorbeeld nemen, kan bij 25 graden Celsius ongeveer 35 gram NaCl worden opgelost in 100 gram water om een verzadigde oplossing te verkrijgen..
Voorbeelden van verdunde oplossingen
Onverzadigde oplossingen zijn dagelijks te vinden, het is niet nodig om in een chemisch laboratorium te zijn.
Het oplosmiddel hoeft niet per se water te zijn. Hieronder staan alledaagse voorbeelden van verdunde oplossingen:
- Door een eetlepel suiker aan een kop hete koffie toe te voegen, ontstaat een onverzadigde suikeroplossing.
- Azijn is een verdunde oplossing van azijnzuur in water.
- Mist is een onverzadigde (maar bijna verzadigde) oplossing van waterdamp in de lucht.
- 0,01 M HCl is een onverzadigde oplossing van zoutzuur in water.
- Ontsmettingsalcohol is een verdunde oplossing van isopropylalcohol in water.
- De soep is een onverzadigde oplossing van water en natriumchloride.
- Alcoholische dranken zijn verdunde oplossingen van ethanol en water. Meestal wordt het percentage alcohol dat ze hebben weergegeven.
Referenties
- Anne Marie Helmenstine, P. (2016, 7 juli). Verzadigde oplossingsdefinitie en voorbeelden. Opgehaald van about.com.
- Cambrige Universiteit. (s.f.). Oplosbaarheidscurves. Opgehaald van dynamicscience.com.au.
- Voorbeelden van verzadigde oplossingen. (s.f.). Opgehaald van example.yourdcitionary.com.
- J., S. (2014, 4 juni). Verzadigde en oververzadigde oplossingen. Opgehaald van socratic.org.
- James, N. (s.f.). Verzadigde oplossing: definitie en voorbeelden. Opgehaald van study.com.
- M., B. (2014, 14 oktober). Verzadigde en oververzadigde oplossingen. Opgehaald van socratic.org.
- Oplosbaarheidscurves. (s.f.). Opgehaald van kentchemistry.com.
- Tipes van verzadiging. (2014, 26 juni). Opgehaald van chem.libretexts.org.



Niemand heeft nog op dit artikel gereageerd.