
Wat zijn waterige oplossingen? (Met voorbeelden)
De waterige oplossingen zijn die oplossingen die water gebruiken om een stof af te breken. Bijvoorbeeld modder of suikerwater. Wanneer een chemische soort is opgelost in water, wordt dit aangegeven door (aq) achter de chemische naam te schrijven.
Hydrofiele (waterminnende) stoffen en veel ionische verbindingen lossen op of dissociëren in water. Wanneer tafelzout of natriumchloride bijvoorbeeld in water oplost, valt het uiteen in zijn ionen om Na + (aq) en Cl- (aq) te vormen..

Hydrofobe (waterafstotende) stoffen lossen over het algemeen niet op in water en vormen geen waterige oplossingen. Het mengen van olie en water leidt bijvoorbeeld niet tot ontbinding of dissociatie.
Veel organische verbindingen zijn hydrofoob. Niet-elektrolyten kunnen oplossen in water, maar ze dissociëren niet in ionen en behouden hun integriteit als moleculen. Voorbeelden van niet-elektrolyten zijn onder meer suiker, glycerol, ureum en methylsulfonylmethaan (MSM).
Eigenschappen van waterige oplossingen
Waterige oplossingen geleiden vaak elektriciteit. Oplossingen met sterke elektrolyten zijn doorgaans goede elektrische geleiders (bijv. Zeewater), terwijl oplossingen met zwakke elektrolyten doorgaans slechte geleiders zijn (bijv. Leidingwater).
De reden is dat sterke elektrolyten volledig dissociëren in ionen in water, terwijl zwakke elektrolyten onvolledig dissociëren..
Wanneer chemische reacties tussen soorten plaatsvinden in een waterige oplossing, zijn de reacties meestal dubbele verplaatsingsreacties (ook wel metathese of dubbele substitutie genoemd)..
Bij dit type reactie neemt het kation in het ene reagens de plaats in van het kation in het andere reagens, waarbij typisch een ionische binding wordt gevormd. Een andere manier om erover na te denken is dat reactieve ionen 'van partner wisselen'.
Reacties in waterige oplossing kunnen producten produceren die oplosbaar zijn in water of kunnen een neerslag produceren..
Een neerslag is een verbinding met een lage oplosbaarheid die vaak als vaste stof uit de oplossing valt..
De termen zuur, base en pH zijn alleen van toepassing op waterige oplossingen. U kunt bijvoorbeeld de pH van citroensap of azijn (twee waterige oplossingen) meten en het zijn zwakke zuren, maar u kunt geen zinvolle informatie krijgen uit de test van plantaardige olie met pH-papier..
Waarom lossen sommige vaste stoffen op in water??
De suiker waarmee we koffie of thee zoeten, is een moleculaire vaste stof, waarin individuele moleculen bij elkaar worden gehouden door relatief zwakke intermoleculaire krachten..
Wanneer suiker oplost in water, worden de zwakke bindingen tussen individuele sucrosemoleculen verbroken en komen deze C12H22O11-moleculen vrij in oplossing..
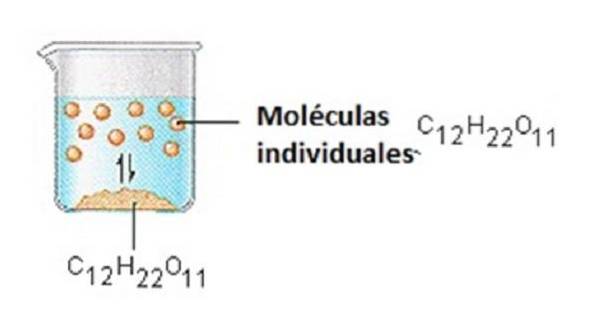
Het kost energie om de bindingen tussen de C12H22O11-moleculen in sucrose te verbreken. Het kost ook energie om de waterstofbruggen in water te verbreken, die moeten worden verbroken om een van deze sucrosemoleculen in oplossing te brengen..
Suiker lost op in water omdat energie vrijkomt wanneer licht polaire sucrosemoleculen intermoleculaire bindingen vormen met polaire watermoleculen..
De zwakke bindingen die ontstaan tussen de opgeloste stof en het oplosmiddel compenseren de energie die nodig is om de structuur van zowel de zuivere opgeloste stof als het oplosmiddel te veranderen..
In het geval van suiker en water werkt dit proces zo goed dat tot 1800 gram sucrose kan worden opgelost in één liter water..
Ionische vaste stoffen (of zouten) bevatten positieve en negatieve ionen, die bij elkaar worden gehouden dankzij de grote aantrekkingskracht tussen deeltjes met tegengestelde ladingen.
Wanneer een van deze vaste stoffen in water oplost, komen de ionen waaruit de vaste stof bestaat, vrij in de oplossing, waar ze zich associëren met de polaire oplosmiddelmoleculen..
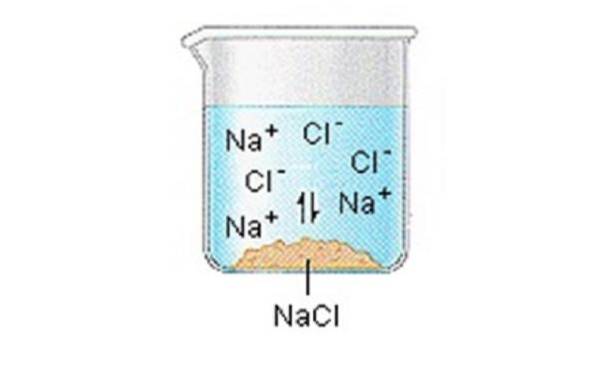
NaCl (s) ”Na + (aq) + Cl- (aq)
Over het algemeen kunnen we aannemen dat zouten dissociëren in hun ionen wanneer ze worden opgelost in water..
Ionische verbindingen lossen op in water als de energie die vrijkomt wanneer de ionen in wisselwerking staan met de watermoleculen groter is dan de energie die nodig is om ionische bindingen in de vaste stof te verbreken en de energie die nodig is om de watermoleculen te scheiden zodat de ionen in de oplossing kunnen worden ingebracht.
Oplosbaarheidsregels
Afhankelijk van de oplosbaarheid van een opgeloste stof zijn er drie mogelijke uitkomsten:
1) Als de oplossing minder opgeloste stof heeft dan de maximale hoeveelheid die deze kan oplossen (de oplosbaarheid), is het een verdunde oplossing;
2) Als de hoeveelheid opgeloste stof precies dezelfde hoeveelheid is als de oplosbaarheid, is deze verzadigd;
3) Als er meer opgeloste stof is dan kan worden opgelost, scheidt de overtollige opgeloste stof zich van de oplossing.
Als dit scheidingsproces kristallisatie omvat, vormt het een neerslag. Neerslag vermindert de concentratie van de opgeloste stof tot verzadiging om de stabiliteit van de oplossing te verhogen..
Hieronder volgen de oplosbaarheidsregels voor gewone ionische vaste stoffen. Als twee regels elkaar lijken tegen te spreken, heeft de vorige voorrang.
1- Zouten die elementen uit groep I bevatten (Li+, Na+, K+, Cs+, Rb+) zijn oplosbaar. Er zijn enkele uitzonderingen op deze regel. Zouten met het ammoniumion (NH4+) zijn ook oplosbaar.
2- Zouten die nitraat bevatten (NO3-) zijn over het algemeen oplosbaar.
3- De zouten die Cl -, Br - of I - bevatten, zijn over het algemeen oplosbaar. Belangrijke uitzonderingen op deze regel zijn de halogenidezouten van Ag+, Pb2+ en (Hg2)twee+. Aldus AgCl, PbBrtwee en HgtweeCltwee ze zijn onoplosbaar.
4- De meeste zilverzouten zijn onoplosbaar. AgNO3 en Ag (CtweeH.3OFtwee) zijn gewone oplosbare zouten van zilver; Vrijwel alle andere zijn onoplosbaar.
5- De meeste sulfaatzouten zijn oplosbaar. Belangrijke uitzonderingen op deze regel zijn onder meer CaSO4, Baso4, PbSO4, AgtweeSO4 en SrSO4.
6- De meeste hydroxidezouten zijn slechts in geringe mate oplosbaar. Hydroxidezouten van elementen van groep I zijn oplosbaar. Hydroxidezouten van elementen uit groep II (Ca, Sr en Ba) zijn enigszins oplosbaar.
De hydroxidezouten van overgangsmetalen en Al3 + ze zijn onoplosbaar. Dus Fe (OH)3, Al (OH)3, Co (OH)twee ze zijn niet oplosbaar.
7- De meeste overgangsmetaalsulfiden zijn zeer onoplosbaar, waaronder CdS, FeS, ZnS en AgtweeS. Arseen, antimoon, bismut en loodsulfiden zijn ook onoplosbaar.
8- Carbonaten zijn vaak onoplosbaar. Groep II-carbonaten (CaCO3, SrCO3 en BaCO3) zijn onoplosbaar, evenals FeCO3 en PbCO3.
9- Chromaten zijn vaak onoplosbaar. Voorbeelden zijn onder meer PbCrO4 en BaCrO4.
10- Fosfaten zoals Ca3(PO4twee en Ag3PO4 zijn vaak onoplosbaar.
11- Fluoriden zoals BaFtwee, MgFtwee en PbFtwee zijn vaak onoplosbaar.
Voorbeelden van oplosbaarheid in waterige oplossingen
Cola, zout water, regen, zuuroplossingen, baseoplossingen en zoutoplossingen zijn voorbeelden van waterige oplossingen. Als u een waterige oplossing heeft, kunt u een neerslag opwekken door neerslagreacties.
Neerslagreacties worden soms "dubbele verplaatsingsreacties" genoemd. Om te bepalen of er zich een neerslag zal vormen wanneer waterige oplossingen van twee verbindingen worden gemengd:
- Registreer alle ionen in oplossing.
- Combineer ze (kation en anion) om alle mogelijke neerslagen te krijgen.
- Gebruik de oplosbaarheidsregels om te bepalen welke (eventuele) combinatie (s) onoplosbaar is en zal neerslaan.
Voorbeeld 1: Wat gebeurt er als Ba (NO3twee (aq) en NatweeCO3 (aq)?
Ionen aanwezig in oplossing: Batwee+, NIET3-, Na+, CO3twee-
Mogelijke neerslag: BaCO3, NaNO3
Oplosbaarheidsregels: BaCO3 is onoplosbaar (regel 5), NaNO3 is oplosbaar (regel 1).
Volledige chemische vergelijking:
Bad3twee(aq) + NatweeCO3(aq) ”BaCO3(s) + 2NaNO3 (aq)
Netto ionische vergelijking:
Batwee+(aq) + CO3twee-(aq) ”BaCO3 (s)
Voorbeeld 2: Wat gebeurt er als Pb (NO3twee (aq) en NH4Ik (aq)?
Ionen aanwezig in oplossing: Pbtwee+, NIET3-, NH4+, ik-
Mogelijke neerslag: PbItwee, NH4NIET3
Oplosbaarheidsregels: PbItwee is onoplosbaar (regel 3), NH4NIET3 is oplosbaar (regel 1).
Volledige chemische vergelijking: Pb (NO32 (aq) + 2NH4ik(aq) ”PbI2 (s) + 2NH4NIET3 (aq)
Netto ionische vergelijking: Pbtwee+(aq) + 2I-(aq) ”PbI2 (s).
Referenties
- Anne Marie Helmenstine. (2017, 10 mei). Waterige definitie (waterige oplossing). Opgehaald van thoughtco.com.
- Anne Marie Helmenstine. (2017, 14 mei). Definitie van waterige oplossing in de chemie. Opgehaald van thoughtco.com.
- Antoinette Mursa, K. W. (2017, 14 mei). Oplosbaarheidsregels. Opgehaald van chem.libretexts.org.
- Waterige oplossingen. (S.F.). Opgehaald van saylordotorg.github.io.
- Berkey, M. (2011, 11 november). Waterige oplossingen: definitie en voorbeelden. Opgehaald van youtube.com.
- Reacties in waterige oplossing. (S.F.). Hersteld van chemistry.bd.psu.edu.
- Reid, D. (S.F.). Waterige oplossing: definitie, reactie en voorbeeld. Opgehaald van study.com.
- Oplosbaarheid. (S.F.). Hersteld van chemed.chem.purdue.edu.


Niemand heeft nog op dit artikel gereageerd.