
Wat zijn twee atomen elementen? (Voorbeelden)
De diatomische elementen, Ook wel homonucleaire diatomische moleculen genoemd, ze bestaan uit slechts twee atomen van dezelfde chemische elementen. Sommige elementen kunnen niet op zichzelf bestaan, zelfs niet als ze geïsoleerd zijn van een ander type atoom.
Elementen van deze aard zullen worden gecombineerd met atomen van hetzelfde element om stabiel te zijn. Met andere woorden, waterstof, een diatomisch element, kan niet op zichzelf zijn. Het kan niet zomaar bestaan H.
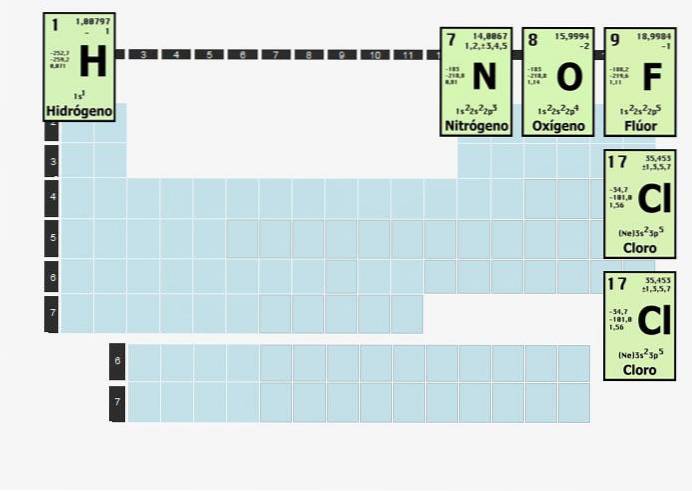
Waterstof is zo reactief dat wanneer het wordt geïsoleerd van alles behalve waterstof, het zich zal combineren tot een diatomisch (twee-atoom) molecuul. Daarom bestaat waterstofgas, dat soms als brandstof wordt gebruikt, als Htwee.
Diatomische moleculen
Diatomische moleculen bevatten twee atomen die chemisch zijn gebonden. Als de twee atomen identiek zijn, zoals het zuurstofmolecuul (Otwee), vormt een homonucleair diatomisch molecuul, terwijl als de atomen verschillend zijn, zoals in het koolmonoxide (CO) -molecuul, het een heteronucleair diatomisch molecuul vormt.
Moleculen die meer dan twee atomen bevatten, worden polyatomaire moleculen genoemd, bijvoorbeeld kooldioxide (COtwee) en water (H.tweeOF). Polymeermoleculen kunnen vele duizenden samenstellende atomen bevatten.
Er zijn zeven elementen waaruit twee atomen moleculen bestaan. De volgende 5 elementgassen worden gevonden als twee atomen moleculen bij kamertemperatuur en druk:
-Waterstof - Htwee
-Stikstof - Ntwee
-Zuurstof - Otwee
-Fluoride - F.twee
-Chloor - Cltwee
Broom en jodium komen vaak voor in vloeibare vorm, maar ook als twee atomen gassen bij iets hogere temperaturen, waardoor er in totaal 7 twee atomen elementen zijn..
-Broom - Brtwee
-Jodium - iktwee
Diatomische elementen zijn halogenen (fluor, chloor, broom, jodium) en elementen met een -gen-uiteinde (waterstof, zuurstof, stikstof). Astatine is een ander halogeen, maar het gedrag is onbekend..
Eigenschappen van twee atomen elementen
Alle twee atomen moleculen zijn lineair, wat de eenvoudigste ruimtelijke ordening van atomen is.
Het is gemakkelijk en gebruikelijk om een diatomisch molecuul voor te stellen als tweepuntsmassa's (de twee atomen) verbonden door een massaloze veer..
De energieën die betrokken zijn bij de bewegingen van het molecuul kunnen worden onderverdeeld in drie categorieën:
- De translationele energieën (het molecuul dat van punt A naar punt B beweegt)
- Rotatie-energieën (het molecuul dat rond zijn as draait)
- Trillingsenergieën (moleculen die op verschillende manieren trillen)
Alle diatomische elementen zijn gassen bij kamertemperatuur, met uitzondering van broom en jodium die vloeibaar zijn (jodium kan zelfs in vaste toestand zijn), en alle met uitzondering van zuurstof en stikstof zijn verbonden door een enkele binding..
Het zuurstofmolecuul heeft zijn twee atomen verbonden door een dubbele binding en het stikstofmolecuul door een drievoudige binding.
Sommige diatomische elementen
Waterstof
Waterstof (H.twee), met atoomnummer 1, is een kleurloos gas dat pas in 1766 formeel als element werd ontdekt door Henry Cavendish, maar ongeveer honderd jaar eerder per ongeluk werd gevonden door Robert Boyle.
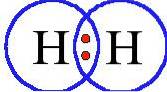
Het is een kleurloos, geurloos, niet-giftig gas dat van nature in ons universum voorkomt. Als eerste element in het periodiek systeem is waterstof het lichtste en meest voorkomende element van alle chemische elementen in het universum, aangezien het 75% van zijn massa uitmaakt..
Stikstof
Stikstof (Ntwee) heeft een atoomnummer van zeven en maakt qua volume ongeveer 78,05% uit van de atmosfeer van de aarde.
Het is een reukloos, kleurloos en meestal inert gas en blijft kleurloos en reukloos in vloeibare toestand..

Zuurstof
Zuurstof (Otwee) heeft een atoomnummer van acht. Dit kleurloze, geurloze gas heeft acht protonen in zijn kern en is lichtblauw in zijn vloeibare en vaste toestand..
Een vijfde van de atmosfeer van de aarde bestaat uit zuurstof en het is qua massa het derde meest voorkomende element in het universum..
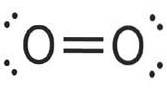
Zuurstof is het meest voorkomende element in massa in de biosfeer van de aarde. De hoge zuurstofconcentratie in de atmosfeer is het resultaat van de zuurstofcyclus van de aarde, die voornamelijk wordt aangedreven door fotosynthese in planten..
Fluor
Fluor (F.twee) heeft een atoomnummer van negen en is de meest reactieve en elektronegatieve van alle elementen. Dit niet-metallische element is een lichtgeel gas dat deel uitmaakt van de halogeengroep.
George Gore was blijkbaar de eerste wetenschapper die fluor isoleerde, maar zijn experiment explodeerde toen het geproduceerde fluor reageerde met waterstof..
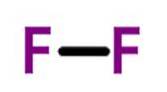
In 1906 ontving Ferdinand Frederic Henri Moissan de Nobelprijs voor scheikunde voor zijn werk aan de isolatie van fluor in 1886. Het is het meest elektronegatieve element op het periodiek systeem..
Chloor
Chloor (Cltwee) is een lid van de halogeengroep met een atoomnummer van zeventien. Een van zijn vormen, NaCl, wordt al sinds de oudheid gebruikt.

Chloor wordt al duizenden jaren in vele andere vormen gebruikt, maar het werd pas in 1810 genoemd door Sir Humphry Davy..
Chloor in zijn pure vorm is geelachtig groen, maar de gebruikelijke verbindingen zijn meestal kleurloos..
Broom
Broom (Brtwee) heeft atoomnummer vijfendertig. Het is een zware donkerbruine vloeistof, het enige niet-metalen element dat een vloeistof is.

Broom werd ontdekt door Antoine J. Balard in 1826. Het werd voor belangrijke doeleinden gebruikt lang voordat het formeel werd ontdekt..
Jodium
Jodium (I.twee) heeft een atoomnummer van drieënvijftig, met drieënvijftig protonen in de kern van een atoom. Het is een blauw-zwart niet-metaal dat een zeer belangrijke rol speelt in de organische chemie..
Jodium werd in 1811 ontdekt door Barnard Courtois. Hij noemde het jodium van het Griekse woord "iodes" wat violet betekent. Het is een effen blauw-zwart.
Jodium speelt een zeer belangrijke rol in de biologie van alle levende organismen, aangezien het tekort leidt tot ziekten zoals hyperthyreoïdie en hypothyreoïdie.
Referenties
- (S.F.). Homonucleaire diatomische moleculen. Hersteld van boundless.com.
- Chloor Feiten. (S.F.). Opgehaald van softschools.com.
- Diatomische elementen. (S.F.). Opgehaald van ths.talawanda.org.
- Encyclopædia Britannica. (2016, 14 september). Molecuul. Opgehaald van britannica.com.
- Helmenstine, A. (2014, 28 september). Diatomische elementen. Opgehaald van sciencenotes.org.
- Helmenstine, A. M. (2017, 29 maart). Wat zijn de zeven diatomische elementen? Opgehaald van thoughtco.com.
- Zuurstof feiten. (S.F.). Opgehaald van softschools.com.
- Royal Society of Chemistry. (2015). moleculair jodium. Opgehaald van chemspider.com.



Niemand heeft nog op dit artikel gereageerd.