
Wat zijn gedegenereerde orbitalen?
De gedegenereerde orbitalen het zijn allemaal degenen die op hetzelfde energieniveau zijn. Volgens deze definitie moeten ze hetzelfde hoofdkwantumnummer hebben n. De 2s- en 2p-orbitalen zijn dus gedegenereerd, omdat ze tot energieniveau 2 behoren. Het is echter bekend dat hun hoek- en radiale golffuncties verschillend zijn..
Zoals de waarden van n, de elektronen beginnen andere energiesubniveaus te bezetten, zoals de d- en f-orbitalen. Elk van deze orbitalen heeft zijn eigen kenmerken, die op het eerste gezicht te zien zijn in hun hoekige vormen; Dit zijn de bolvormige (s), halter (p), klaverblad (d) en bolvormige (f) cijfers.
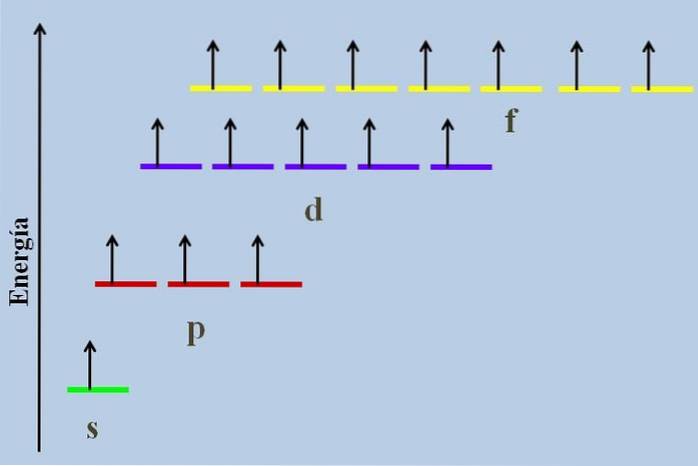
Tussen hen is er een energetisch verschil, ook al behoren ze tot hetzelfde niveau n.
De afbeelding hierboven toont bijvoorbeeld een energieschema met de orbitalen bezet door ongepaarde elektronen (een abnormaal geval). Het kan worden gezien dat van al de meest stabiele (degene met de laagste energie) de ns (1s, 2s, ...) orbitaal is, terwijl de nf de meest onstabiele is (degene met de hoogste energie).
Artikel index
- 1 Gedegenereerde orbitalen van een geïsoleerd atoom
- 1.1 Orbitalen p
- 1.2 Orbitalen d
- 1.3 Orbitalen f
- 2 gedegenereerde hybride orbitalen
- 3 referenties
Gedegenereerde orbitalen van een geïsoleerd atoom
Gedegenereerde orbitalen, met dezelfde waarde van n, ze zitten op dezelfde lijn in een energieschema. Om deze reden bevinden de drie rode strepen die de p-orbitalen symboliseren zich op dezelfde lijn; net als de paarse en gele strepen op dezelfde manier.
Het diagram in de afbeelding is in strijd met de regel van Hund: de orbitalen met hogere energie zijn gevuld met elektronen zonder ze eerst te koppelen in de orbitalen met lagere energie. Terwijl de elektronen paren, verliest de orbitaal energie en oefent een grotere elektrostatische afstoting uit op de ongepaarde elektronen van de andere orbitalen..
Dergelijke effecten worden in veel energiediagrammen echter niet in aanmerking genomen. Als dat zo is, en de regel van Hund gehoorzamen zonder de d-orbitalen volledig te vullen, zou het duidelijk zijn dat ze niet langer gedegenereerd zijn.
Zoals eerder vermeld, heeft elke orbitaal zijn eigen kenmerken. Een geïsoleerd atoom, met zijn elektronische configuratie, heeft zijn elektronen gerangschikt in het exacte aantal orbitalen om ze te huisvesten. Alleen degenen die qua energie gelijk zijn, kunnen als gedegenereerd worden beschouwd.
Orbitalen p
De drie rode strepen voor de gedegenereerde p-orbitalen in de afbeelding geven aan dat beide pX, pY En Pz ze hebben dezelfde energie. Er is een ongepaard elektron in elk, beschreven door vier kwantumgetallen (n, l, ml Y Mevrouw), terwijl de eerste drie de orbitalen beschrijven.
Het enige verschil tussen hen wordt aangegeven door het magnetische moment ml, die het pad trekt van pX op een x-as, pY op de y-as, en pz op de z-as. Alle drie zijn hetzelfde, maar verschillen alleen in hun ruimtelijke oriëntatie. Om deze reden worden ze altijd uitgelijnd in energie getekend, dat wil zeggen gedegenereerd.
Omdat ze hetzelfde zijn, een geïsoleerd stikstofatoom (met 1s-configuratietwee2 sectwee2 Blz3) moeten zijn drie p-orbitalen gedegenereerd houden. Het energiescenario verandert echter abrupt als men een N-atoom in een molecuul of chemische verbinding beschouwt..
Waarom? Omdat hoewel pX, pY En Pz ze zijn gelijk in energie, dit kan in elk van hen variëren als ze verschillende chemische omgevingen hebben; dat wil zeggen, als ze aan verschillende atomen binden.
Orbitalen d
Er zijn vijf paarse strepen die de d-orbitalen aanduiden. In een geïsoleerd atoom, zelfs als ze elektronenparen hebben, worden deze vijf orbitalen als gedegenereerd beschouwd. In tegenstelling tot de p-orbitalen is er deze keer echter een duidelijk verschil in hun hoekige vormen.
Daarom reizen zijn elektronen richtingen in de ruimte die variëren van de ene d-orbitaal naar de andere. Dit veroorzaakt volgens kristalveldtheorie, dat een minimale storing een energie splitsen van de orbitalen; dat wil zeggen, de vijf paarse strepen scheiden zich, waardoor er een energiekloof tussen hen ontstaat:
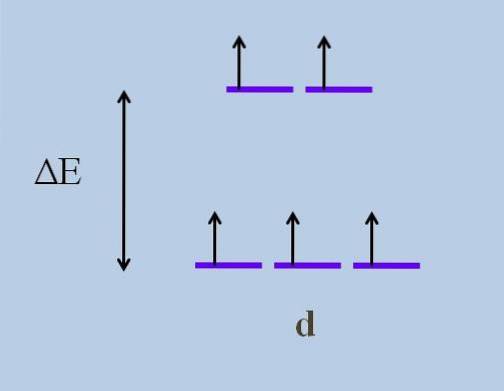
Wat zijn de bovenste orbitalen en wat zijn de onderste orbitalen? De bovenstaande worden gesymboliseerd als eng, en die hieronder t2 g. Merk op hoe aanvankelijk alle paarse strepen waren uitgelijnd en nu een set van twee orbitalen werd gevormd eng energieker dan de andere set van drie orbitalen t2 g.
Deze theorie stelt ons in staat de d-d-overgangen te verklaren, waaraan veel van de kleuren die worden waargenomen in de verbindingen van de overgangsmetalen (Cr, Mn, Fe, enz.) Worden toegeschreven. En wat is de oorzaak van deze elektronische storing? Om de coördinatie-interacties van het metaalcentrum met andere moleculen te noemen liganden.
Orbitalen f
En met de f orbitalen, de viltgele strepen, wordt de situatie nog ingewikkelder. Hun ruimtelijke richtingen variëren erg tussen hen, en de weergave van hun links wordt te complex.
In feite wordt aangenomen dat de f orbitalen zo intern omhuld zijn dat ze niet "merkbaar deelnemen" aan de vorming van obligaties..
Wanneer het geïsoleerde atoom met f-orbitalen zichzelf omringt met andere atomen, beginnen interacties en vindt ontvouwing plaats (het verlies van degeneratie):
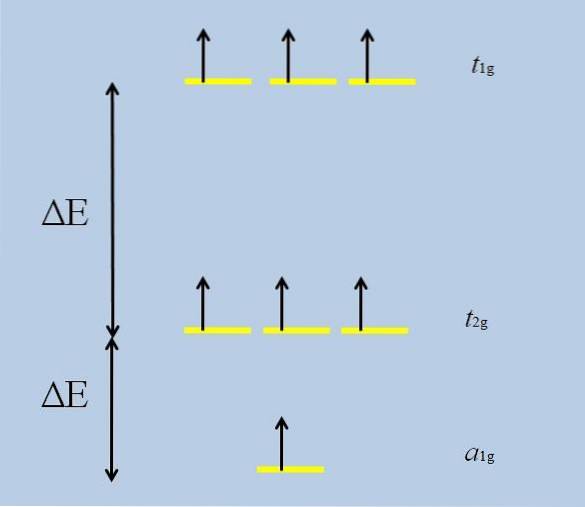
Merk op dat de gele strepen nu drie sets vormen: t1 g, t2 g Y naar1 g, en dat ze niet langer gedegenereerd zijn.
Gedegenereerde hybride orbitalen
Men heeft gezien dat de orbitalen zich kunnen ontvouwen en degeneratie verliezen. Hoewel dit elektronische overgangen verklaart, verbleekt het bij het verduidelijken van hoe en waarom er verschillende moleculaire geometrieën zijn. Dit is waar hybride orbitalen binnenkomen..
Wat zijn de belangrijkste kenmerken? Dat ze gedegenereerd zijn. Ze komen dus voort uit het mengsel van karakters van orbitalen s, p, d en f, om gedegenereerde hybriden te creëren.
Drie p-orbitalen worden bijvoorbeeld gemengd met één s om vier sp-orbitalen te geven3. Alle sp-orbitalen3 zijn gedegenereerd en hebben daarom dezelfde energie.
Als bovendien twee d-orbitalen worden gemengd met de vier sp3, je krijgt zes sp-orbitalen3dtwee.
En hoe verklaren ze moleculaire geometrieën? Omdat er zes zijn, met gelijke energieën, moeten ze daarom symmetrisch in de ruimte worden georiënteerd om gelijke chemische omgevingen te genereren (bijvoorbeeld in een MF-verbinding6.
Wanneer ze dat doen, wordt een coördinatie-octaëder gevormd, die gelijk is aan een octaëdrische geometrie rond een middelpunt (M).
Geometrieën zijn echter vaak vervormd, wat betekent dat zelfs hybride orbitalen niet echt volledig gedegenereerd zijn. Daarom, bij wijze van conclusie, bestaan gedegenereerde orbitalen alleen in geïsoleerde atomen of in zeer symmetrische omgevingen..
Referenties
- Chemicool Dictionary. (2017). Definitie van gedegenereerde. Hersteld van: chemicool.com
- SparkNotes LLC. (2018). Atomen en atomaire orbitalen. Hersteld van: sparknotes.com
- Pure chemie. (s.f.). Elektronische configuratie. Hersteld van: es-puraquimica.weebly.com
- Whitten, Davis, Peck & Stanley. (2008). Chemie. (8e ed.). CENGAGE Leren.
- Moreno R. Esparza. (2009). Cursus Coördinatiechemie: Velden en orbitalen. [Pdf]. Hersteld van: depa.fquim.unam.mx
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.



Niemand heeft nog op dit artikel gereageerd.