
Chiraliteit waaruit het bestaat en voorbeelden
De chiraliteit Het is een geometrische eigenschap waarin een object twee afbeeldingen kan hebben: een rechts en een links, die niet uitwisselbaar zijn; dat wil zeggen, ze zijn ruimtelijk verschillend, ook al is de rest van hun eigenschappen identiek. Een object dat chiraliteit vertoont, wordt eenvoudigweg 'chiraal' genoemd.
De rechter- en linkerhand zijn chiraal: de ene is de weerspiegeling (spiegelbeeld) van de andere, maar ze zijn niet hetzelfde, aangezien hun duimen niet samenvallen wanneer ze op elkaar worden geplaatst.
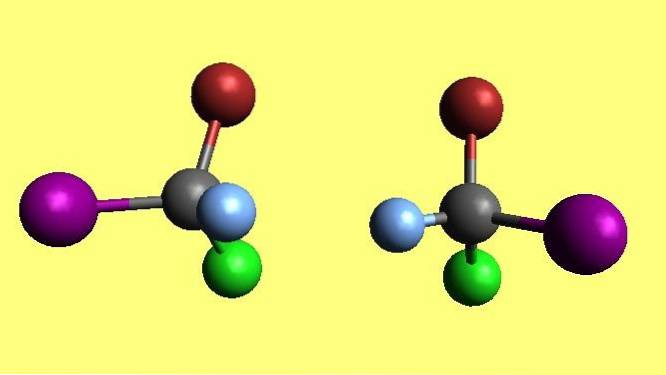
Meer dan een spiegel, om te weten of een object chiraal is, moet de volgende vraag worden gesteld: heeft het "versies" voor zowel de linker- als de rechterkant?
Een linkshandig bureau en een rechtshandig bureau zijn bijvoorbeeld chirale objecten; twee voertuigen van hetzelfde model maar met het stuur links of rechts; een paar schoenen, evenals voeten; wenteltrappen in de linker richting, en in de goede richting, etc..
En in de chemie zijn moleculen geen uitzondering: ze kunnen ook chiraal zijn. De afbeelding toont een paar moleculen met tetraëdrische geometrie. Zelfs als degene aan de linkerkant wordt omgedraaid en de blauwe en paarse bollen elkaar raken, zullen de bruine en groene bollen uit het vlak "kijken"..
Artikel index
- 1 Wat is chiraliteit?
- 2 Voorbeelden van chiraliteit
- 2.1 Axiaal
- 2.2 Planair
- 2.3 Andere
- 3 referenties
Wat is chiraliteit?
Met moleculen is het niet zo eenvoudig om te bepalen welke de linker of rechter ‘versie’ is door ernaar te kijken. Hiervoor nemen organische chemici hun toevlucht tot de Cahn-Ingold-Prelog (R) of (S) -configuraties, of in de optische eigenschap van deze chirale stoffen om gepolariseerd licht te roteren (wat ook een chiraal element is)..
Het is echter niet moeilijk om te bepalen of een molecuul of verbinding chiraal is door alleen naar de structuur te kijken. Wat is het opvallende kenmerk van het paar moleculen in de bovenste afbeelding??
Het heeft vier verschillende substituenten, elk met zijn eigen karakteristieke kleur, en ook de geometrie rond het centrale atoom is tetraëder..
Als er in een structuur een atoom is met vier verschillende substituenten, kan (in de meeste gevallen) worden gesteld dat het molecuul chiraal is.
Dan wordt er gezegd dat er in de structuur een centrum van chiraliteit is of stereogeen centrum. Waar er een is, zal er een paar stereo-isomeren zijn die bekend staan als enantiomeren.
De twee moleculen in de afbeelding zijn enantiomeren. Hoe groter het aantal chirale centra dat een verbinding bezit, hoe groter de ruimtelijke diversiteit..
Het centrale atoom is over het algemeen een koolstofatoom in alle biomoleculen en verbindingen met farmacologische activiteit; het kan echter ook fosfor, stikstof of een metaal zijn.
Voorbeelden van chiraliteit
Het centrum van chiraliteit is misschien wel een van de belangrijkste elementen om te bepalen of een verbinding al dan niet chiraal is..
Er zijn echter nog andere factoren die misschien onopgemerkt blijven, maar in 3D-modellen laten ze een spiegelbeeld zien dat niet kan worden over elkaar heen gelegd..
Voor deze structuren wordt dan gezegd dat ze in plaats van het centrum andere elementen van chiraliteit hebben. Met dit in gedachten is de aanwezigheid van een asymmetrisch centrum met vier substituenten niet langer voldoende, maar moet ook de rest van de structuur zorgvuldig worden geanalyseerd; en dus in staat zijn om de ene stereo-isomeer van de andere te onderscheiden.
Axiaal

De hierboven getoonde verbindingen kunnen met het blote oog plat lijken, maar dat zijn ze in werkelijkheid niet. Aan de linkerkant is de algemene structuur van een alleen, waarbij R de vier verschillende substituenten aangeeft; en aan de rechterkant de algemene structuur van een bifenylverbinding.
Het extreme waar R samenkomt3 en R4 kan worden gevisualiseerd als een "vin" loodrecht op het vlak waar R ligt1 en Rtwee.
Als een waarnemer dergelijke moleculen analyseert door het oog voor de eerste koolstof gebonden aan R te plaatsen1 en Rtwee (voor alene), zie je R1 en Rtwee naar links en rechts, en naar R4 en R3 omhoog en omlaag.
Als R3 en R4 blijven vast, maar worden gewijzigd R1 aan de rechterkant, en Rtwee aan de linkerkant is er dan nog een 'ruimtelijke versie'.
Hier kan de waarnemer dan concluderen dat hij een as van chiraliteit voor allene heeft gevonden; hetzelfde gebeurt met bifenyl, maar met de aromatische ringen die bij het zien betrokken zijn.
Ringschroeven of Helicity
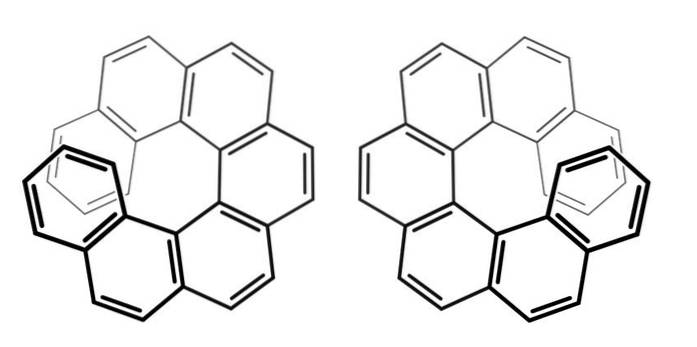
Merk op dat in het vorige voorbeeld de chiraliteitsas lag in het C = C = C-skelet, voor alleen, en in de Ar-Ar-binding, voor bifenyl.
Wat is hun chiraliteitsas voor de verbindingen die hierboven heptahelcenen worden genoemd (omdat ze zeven ringen hebben)? Het antwoord wordt gegeven in dezelfde afbeelding hierboven: de Z-as, die van de propeller.
Om de ene enantiomeer van de andere te onderscheiden, moet je deze moleculen daarom van bovenaf bekijken (bij voorkeur).
Op deze manier kan worden gedetailleerd dat een heptahelicene met de klok mee draait (linkerkant van de afbeelding) of tegen de klok in (rechterkant van de afbeelding)..
Planar
Stel dat je geen helicen meer hebt, maar een molecuul met niet-coplanaire ringen; dat wil zeggen, de ene bevindt zich boven of onder de andere (of ze bevinden zich niet in hetzelfde vlak).
Hier rust het chirale karakter niet zozeer op de ring, maar op zijn substituenten; dit zijn degenen die elk van de twee enantiomeren definiëren.

In het ferroceen in de bovenste afbeelding bijvoorbeeld, veranderen de ringen die het Fe-atoom "sandwichen" niet; maar de ruimtelijke oriëntatie van de ring met het stikstofatoom en de groep -N (CH3twee.
In de afbeelding is de groep -N (CH3twee wijst naar links, maar in zijn enantiomeer zal het naar rechts wijzen.
Anderen
Voor macromoleculen of die met enkelvoudige structuren begint het beeld te vereenvoudigen. Waarom? Omdat het aan hun 3D-modellen mogelijk is om vanuit vogelperspectief te zien of ze chiraal zijn of niet, zoals bij de objecten in de eerste voorbeelden..
Een koolstofnanobuisje kan bijvoorbeeld patronen van bochten naar links vertonen, en daarom is het chiraal als er een identiek is, maar met bochten naar rechts..
Hetzelfde gebeurt met andere structuren waar, ondanks dat ze geen chiraliteitscentra hebben, de ruimtelijke ordening van al hun atomen chirale vormen kan aannemen..
We spreken dan van een inherente chiraliteit, die niet afhankelijk is van een atoom maar van de hele verzameling..
Een chemisch krachtige manier om het "linkerbeeld" van het rechterbeeld te onderscheiden is door middel van een stereoselectieve reactie; dat wil zeggen, een waar het alleen kan voorkomen met één enantiomeer, terwijl met het andere nr.
Referenties
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Wikipedia. (2018). Chiraliteit (chemie). Hersteld van: en.wikipedia.org
- Advameg, Inc. (2018). Chiraliteit. Hersteld van: chemistryexplained.com
- Steven A. Hardinger en Harcourt Brace & Company. (2000). Stereochemie: bepaling van moleculaire chiraliteit. Hersteld van: chem.ucla.edu
- Harvard universiteit. (2018). Moleculaire chiraliteit. Hersteld van: rowland.harvard.edu
- Oregon State University. (14 juli 2009). Chiraliteit: chirale en achirale objecten. Hersteld van: science.oregonstate.edu


Niemand heeft nog op dit artikel gereageerd.