
Hunds regel of principe van maximale veelheid
De Hunds regel of principe van maximale veelheid stelt empirisch vast hoe de door energie gedegenereerde orbitale elektronen moeten bezetten. Deze regel kwam, zoals de naam alleen al suggereert, van de Duitse natuurkundige Friedrich Hund in 1927, en is sindsdien zeer nuttig geweest in de kwantum- en spectroscopische chemie..
Er zijn in feite drie regels van Hund die in de kwantumchemie worden toegepast; De eerste is echter de eenvoudigste voor het basiskennis van hoe een atoom elektronisch kan worden gestructureerd.
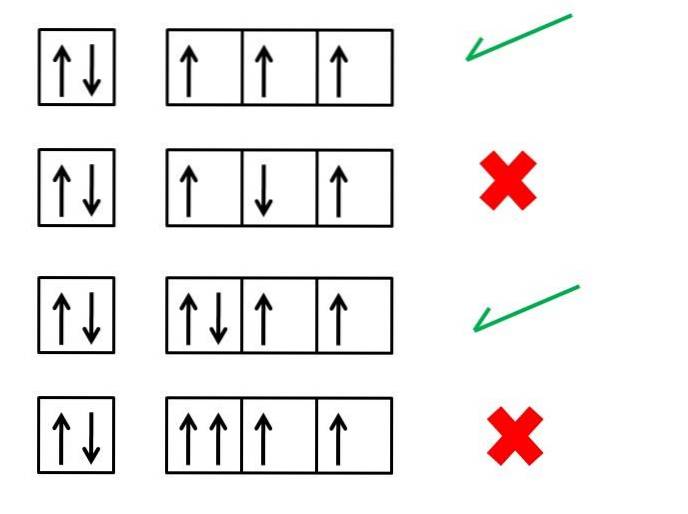
De eerste regel van Hund, die van maximale veelvoudigheid, is essentieel om de elektronische configuraties van de elementen te begrijpen; stelt vast wat de ordening van de elektronen in de orbitalen zou moeten zijn om een atoom (ion of molecuul) met grotere stabiliteit te genereren.
De afbeelding hierboven toont bijvoorbeeld vier reeksen elektronenconfiguraties; de dozen stellen de orbitalen voor en de zwarte pijlen stellen de elektronen voor.
De eerste en derde reeks komen overeen met de juiste manieren om de elektronen te ordenen, terwijl de tweede en vierde reeks aangeven hoe de elektronen niet in de orbitalen moeten worden geplaatst..
Artikel index
- 1 Volgorde van het vullen van de orbitalen volgens de regel van Hund
- 1.1 Koppelen van spins
- 1.2 Parallelle en antiparallelle spins
- 2 Veelvoud
- 3 oefeningen
- 3.1 Fluor
- 3.2 Titanium
- 3.3 IJzer
- 4 referenties
Orbitale vulopdracht volgens de regel van Hund
Hoewel er geen melding wordt gemaakt van de andere twee Hund-regels, past het correct uitvoeren van de vulopdracht impliciet deze drie regels tegelijkertijd toe.
Wat hebben de eerste en derde reeks orbitalen in de afbeelding gemeen? Waarom kloppen ze? Om te beginnen kan elke orbitaal slechts twee elektronen 'huisvesten', daarom is de eerste doos compleet. Het vullen moet dus doorgaan met de drie dozen of orbitalen aan de rechterkant.
Spin paring
Elk vakje in de eerste reeks heeft een naar boven wijzende pijl, die drie elektronen symboliseert met spins in dezelfde richting. Als ze naar boven wijzen, betekent dit dat hun spins een waarde van +1/2 hebben, en als ze naar beneden wijzen, hebben hun spins waarden van -1/2.
Merk op dat de drie elektronen verschillende orbitalen bezetten, maar met ongepaarde spins.
In de derde reeks bevindt het zesde elektron zich met een spin in de tegenovergestelde richting, -1/2. Dit is niet het geval voor de vierde reeks, waar dit elektron de orbitaal binnenkomt met een spin van +1/2.
En dus zullen de twee elektronen, net als die van de eerste orbitaal, hun gepaarde spins (een met spin +1/2 en een met spin -1/2).
De vierde reeks dozen of orbitalen is in strijd met het Pauli-uitsluitingsprincipe, dat stelt dat geen enkel elektron dezelfde vier kwantumgetallen kan hebben. De regel van Hund en het uitsluitingsprincipe van Pauli gaan altijd hand in hand.
Daarom moeten de pijlen zo worden geplaatst dat ze ongepaard zijn totdat ze alle dozen bezetten; en onmiddellijk daarna worden ze aangevuld met de pijlen die in de tegenovergestelde richting wijzen.
Parallelle en antiparallelle spins
Het is niet voldoende dat elektronen hun spins gepaard hebben: ze moeten ook parallel zijn. Dit in de weergave van dozen en pijlen wordt gegarandeerd door deze met hun uiteinden parallel aan elkaar te plaatsen..
De tweede reeks geeft de fout weer dat het elektron in het derde vak zijn spin in antiparallelle zin ontmoet ten opzichte van de andere..
Het kan dus worden samengevat dat de grondtoestand van een atoom er een is die voldoet aan de regels van Hund en daarom de meest stabiele elektronische structuur heeft.
De theoretische en experimentele basis bevestigt dat wanneer een atoom elektronen heeft met een groter aantal ongepaarde en parallelle spins, het stabiliseert als resultaat van een toename van elektrostatische interacties tussen de kern en de elektronen; toename die het gevolg is van de afname van het afschermende effect.
Veelheid
In het begin werd het woord 'veelvoud' genoemd, maar wat betekent het in deze context? De eerste regel van Hund stelt vast dat de meest stabiele grondtoestand voor een atoom degene is met het hoogste aantal spin-multipliciteit; met andere woorden, degene met zijn orbitalen met het hoogste aantal ongepaarde elektronen.
De formule om de veelvoud van de spin te berekenen is
2S + 1
Waarbij S gelijk is aan het aantal ongepaarde elektronen vermenigvuldigd met 1/2. Met verschillende elektronische structuren met hetzelfde aantal elektronen, kan 2S + 1 dus voor elk worden geschat en degene met de hoogste multipliciteitswaarde zal het meest stabiel zijn..
De spin-multipliciteit kan worden berekend voor de eerste reeks orbitalen met drie elektronen met hun spins ongeëvenaard en parallel:
S = 3 (1/2) = 3/2
En de veelheid is dan
2 (3/2) + 1 = 4
Dit is de eerste regel van Hund. De meest stabiele configuratie moet ook voldoen aan andere parameters, maar die zijn voor chemisch inzicht niet helemaal noodzakelijk..
Opleiding
Fluor
Alleen de valentieschil wordt in aanmerking genomen, aangezien wordt aangenomen dat de binnenschil al gevuld is met elektronen. De elektronenconfiguratie van fluor is daarom [He] 2stwee2 Blz5.
Een 2s-orbitaal moet eerst worden gevuld en vervolgens drie p-orbitalen. Om de 2s-orbitaal met de twee elektronen te vullen, volstaat het om ze zo te plaatsen dat hun spins gepaard zijn.
De andere vijf elektronen voor de drie 2p-orbitalen zijn gerangschikt zoals hieronder geïllustreerd.
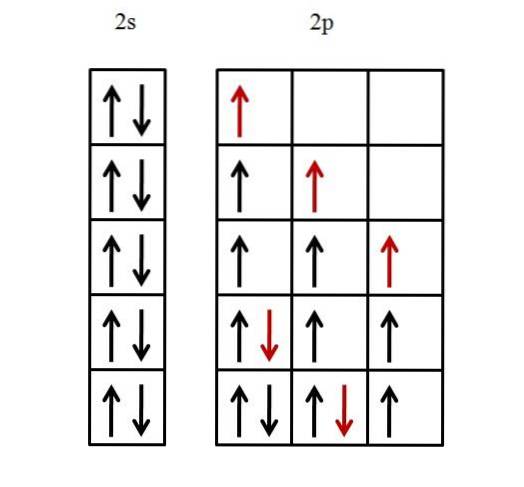
De rode pijl vertegenwoordigt het laatste elektron dat de orbitalen vult. Merk op dat de eerste drie elektronen die de 2p-orbitalen binnenkomen, ongepaard zijn geplaatst en met hun spins parallel.
Dan, vanaf het vierde elektron, begint het zijn spin -1/2 te paren met het andere elektron. Het vijfde en laatste elektron verloopt op dezelfde manier.
Titanium
De elektronenconfiguratie van titanium is [Ar] 3dtwee4stwee. Omdat er vijf d-orbitalen zijn, wordt voorgesteld om aan de linkerkant te beginnen:
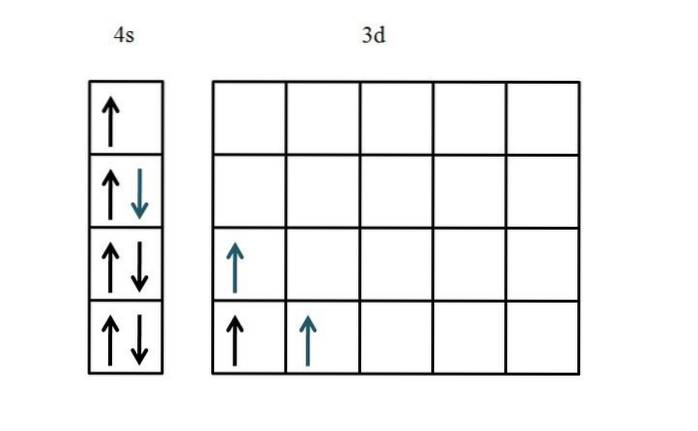
Dit keer werd de vulling van de 4s-orbitaal getoond. Omdat er slechts twee elektronen in de 3d orbitalen zijn, is er bijna geen probleem of verwarring bij het plaatsen ervan met hun ongepaarde en parallelle spins (blauwe pijlen).
Ijzer
Een ander voorbeeld, en ten slotte, is ijzer, een metaal dat meer elektronen in zijn d-orbitalen heeft dan titanium. De elektronenconfiguratie is [Ar] 3d64stwee.
Als de regel van Hund en het uitsluitingsprincipe van Pauli er niet waren geweest, zouden we niet weten hoe we zulke zes elektronen in hun vijf d-orbitalen moeten rangschikken..
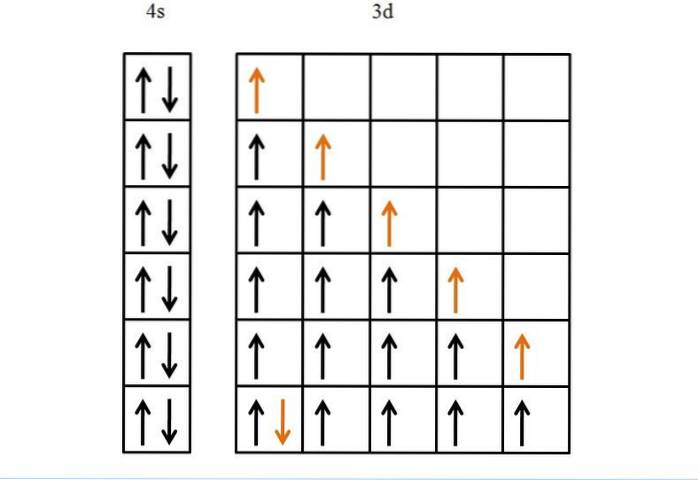
Hoewel het misschien eenvoudig lijkt, zouden zonder deze regels veel verkeerde mogelijkheden kunnen ontstaan met betrekking tot de volgorde van het vullen van de orbitalen.
Dankzij deze is de voortgang van de gouden pijl logisch en eentonig, wat niets meer is dan het laatste elektron dat in de orbitalen wordt geplaatst..
Referenties
- Serway & Jewett. (2009). Fysica: voor wetenschap en techniek met moderne fysica. Deel 2. (zevende editie). Cengage leren.
- Glasstone. (1970). Leerboek van fysische chemie. In Chemische kinetica. Tweede druk. D. Van Nostrand, Company, Inc.
- Méndez A. (21 maart 2012). Hund's regel. Hersteld van: quimica.laguia2000.com
- Wikipedia. (2018). Hunds regel van maximale veelheid. Hersteld van: en.wikipedia.org
- Chemie LibreTexts. (23 augustus 2017). Hund's Rules. Hersteld van: chem.libretexts.org
- Schip R. (2016). Hund's Rules. Hersteld van: hyperphysics.phy-astr.gsu.edu



Niemand heeft nog op dit artikel gereageerd.