
Resistin kenmerken, structuur, functies
De weerstand bieden, Ook bekend als adipose tissue specific secretory factor (ADSF), het is een peptidehormoon dat rijk is aan cysteïne. De naam is te danken aan de positieve correlatie (resistentie) die het presenteert met de werking van insuline. Het is een cytokine met 10 tot 11 cysteïneresiduen.
Het werd in 2001 ontdekt in vetcellen (vetweefsel) van muizen en in immuun- en epitheelcellen van mensen, honden, varkens, ratten en verschillende soorten primaten..
Artikel index
- 1 Algemene kenmerken
- 1.1 Bij muizen
- 1.2 Bij mensen
- 2 Synonymie
- 3 Ontdekking
- 3.1 FIZZ3
- 3.2 ADSF
- 3.3 Resistin
- 4 Structuren
- 5 functies
- 6 ziekten
- 7 referenties
Algemene karakteristieken
Resistin maakt deel uit van een familie van resistine-achtige moleculen (resistine-achtige moleculen, RELM's). Alle leden van de RELMs-familie presenteren een N-terminale sequentie, die het secretiesignaal presenteert dat tussen 28 en 44 residuen ligt.
Ze hebben een variabele centrale regio of zone, met een carboxyluiteinde, van een domein dat varieert tussen 57 en ongeveer 60 residuen, sterk geconserveerd of geconserveerd en overvloedig aanwezig in cysteïne.
Dit eiwit is bij verschillende zoogdieren aangetroffen. De meeste aandacht is gericht op resistine dat door muizen wordt uitgescheiden en bij mensen aanwezig is. Deze twee eiwitten hebben 53 tot 60% gelijkenis (homologieën) in hun aminozuursequenties..
In muizen
Bij deze zoogdieren is de belangrijkste bron van resistine de vetcellen of wit vetweefsel.
Resistine bij muizen is rijk aan cysteïne van 11 kDa. Het gen voor dit eiwit bevindt zich op het achtste (8) chromosoom. Het wordt gesynthetiseerd als een precursor van 114 aminozuren. Ze hebben ook een signaalsequentie van 20 aminozuren en een rijp segment van 94 aminozuren..
Structureel resistine bij muizen heeft vijf disulfidebindingen en meerdere β-bochten. Het kan complexen vormen van twee identieke moleculen (homodimeren) of eiwitten vormen met quaternaire structuren (multimeren) van verschillende grootte dankzij de disulfide- en niet-disulfidebindingen.
In mensen
Humaan resistine wordt gekenmerkt doordat het, zoals bij muizen of andere dieren, een peptide-eiwit is dat rijk is aan cysteïne, alleen bij mensen is het 12 kDa, met een rijpe sequentie van 112 aminozuren.
Het gen voor dit eiwit bevindt zich op chromosoom 19. De bron van resistine bij mensen zijn macrofaagcellen (cellen van het immuunsysteem) en epitheelweefsel. Circuleert in het bloed als een dimeer eiwit van 92 aminozuren verbonden door disulfidebindingen.

Synonymie
Resistine is bekend onder meerdere namen, waaronder: cysteïnerijk uitgescheiden eiwit FIZZ3 (cysteïnerijk uitgescheiden eiwit FIZZ3), vetweefsel-specifieke uitscheidingsfactor (ADSF), vetweefsel-specifieke uitscheidingsfactor (ADSF), eiwit rijk aan C / EBP -epsilon-gereguleerd myeloïde-specifiek uitgescheiden cysteïnerijk eiwit, uitgescheiden cysteïnerijk eiwit A12-alfa-achtig 2 (cysteïnerijk uitgescheiden eiwit A12-alfa-achtig 2), RSTN, XCP1, RETN1, MGC126603 en MGC126609.
Ontdekking
Dit eiwit is relatief nieuw voor de wetenschappelijke gemeenschap. Het werd begin deze eeuw onafhankelijk ontdekt door drie groepen wetenschappers, die het verschillende namen gaven: FIZZ3, ADSF en resistin..
FIZZ3
Het werd in 2000 ontdekt in ontstoken longweefsel. Drie genen van muizen en twee homologe genen van mensen geassocieerd met de productie van dit eiwit werden geïdentificeerd en beschreven..
ADSF
Eiwit ontdekt in 2001, dankzij de identificatie van een uitscheidingsfactor die rijk is aan cystine (Ser / Cys) (ADSF) specifiek voor wit lipidenweefsel (adiposieten).
Dit eiwit kreeg een belangrijke rol toebedeeld in het differentiatieproces van multipotente cellen tot volwassen adiposieten (adipogenese).
Resistin
Eveneens in 2001 beschreef een groep onderzoekers hetzelfde eiwit dat rijk is aan cystine in het rijpe lipidenweefsel van muizen, dat ze resistine noemden vanwege de resistentie tegen insuline..
Structuren
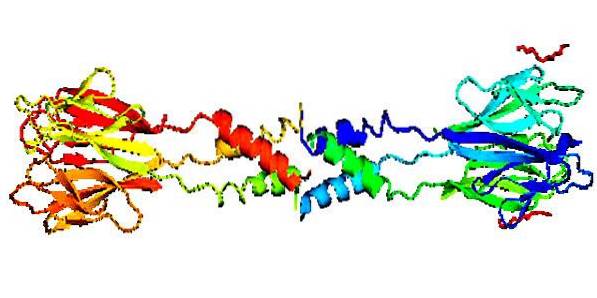
Structureel is bekend dat dit eiwit bestaat uit een laminair gevormd front- of hoofdgedeelte en een spiraalvormig achtergedeelte (staart), waarbij oligomeren met verschillende molecuulgewichten worden gevormd, afhankelijk van of het menselijk of van een andere oorsprong is..
Het heeft een centraal gebied met 11 residuen van Ser / Cys (Serine / Cysteïne) en een gebied dat ook rijk is aan Ser / Cys waarvan de sequentie CX11CX8CXCX3CX10CXCXCX9CCX3-6 is, waarbij C Ser / Cys is en X elk aminozuur..
Het heeft een structurele samenstelling die als ongebruikelijk wordt beschouwd, omdat het wordt gevormd door verschillende subeenheden die zijn verbonden door niet-covalente interacties, dat wil zeggen dat ze geen elektronen gebruiken, maar verspreide elektromagnetische variaties om hun structuur samen te stellen..
Kenmerken
De functies van resistine zijn tot op heden onderwerp van uitgebreid wetenschappelijk debat. Een van de meest relevante bevindingen van de biologische effecten bij mensen en muizen zijn:
- Meerdere weefsels bij mensen en muizen reageren op resistine, waaronder lever-, spier-, hart-, immuun- en vetcellen.
- Hyperresistinemische muizen (dat wil zeggen, met verhoogde niveaus van resistine) ervaren een verminderde zelfregulatie van glucose (homeostase).
- Resistin vermindert de door insuline gestimuleerde glucoseopname in hartspiercellen.
- In immuuncellen (macrofagen) bij mensen induceert resistine de productie van eiwitten die de reactie van het immuunsysteem coördineren (inflammatoire cytokines)
Ziekten
Bij mensen wordt aangenomen dat dit eiwit fysiologisch bijdraagt aan insulineresistentie bij diabetes mellitus..
De rol die het speelt bij obesitas is nog onbekend, hoewel is vastgesteld dat er een verband bestaat tussen verhoogde vetweefsel- en resistinegehalten, dat wil zeggen dat obesitas de concentratie van resistine in het lichaam verhoogt. Het is ook aangetoond dat het verantwoordelijk is voor hoge niveaus van slechte cholesterol in het bloed.
Resistin moduleert moleculaire routes in inflammatoire en auto-immuunpathologieën. Het veroorzaakt direct de functionele verandering van het endotheel, wat op zijn beurt leidt tot verharding van de slagaders, ook bekend als atheroschlorose.
Resistin werkt als een indicator van ziekte en zelfs als een voorspellende klinische tool voor hart- en vaatziekten. Het is onder meer betrokken bij de aanmaak van bloedvaten (angiogenese), trombose, astma, niet-alcoholische leververvetting, chronische nierziekte.
Referenties
- DC Juan, L.S. Kan, C.C. Huang, S.S. Chen, L.T. Ho, L.C. Au (2003). Productie en karakterisering van bioactieve recombinante resistine in Escherichia coli. Journal of Biotechnology.
- Menselijke weerstand. Pospec. Opgehaald van prospecbio.com.
- S. Abramson. Resistim. Hersteld van collab.its.virginia.edu.
- G. Wolf (2004), Insulineresistentie en obesitas: resistine, een hormoon dat wordt uitgescheiden door vetweefsel. Nutrition beoordelingen.
- M. Rodríguez Pérez (2014), Studie van de biologische functies van S-Resistin. Rapport gepresenteerd aan de Universiteit van Castilla-La Mancha, om de titel van doctor in de biochemie aan te vragen. 191.
- A. Souki, N.J. Arráiz-Rodríguez, C. Prieto-Fuenmayor,… C. Cano-Ponce (2018), Basisaspecten bij obesitas. Barranquilla, Colombia: Simón Bolívar University Editions. 44 p.
- Md.S. Jamaluddin, S.M. Weakley, Q. Yao en C. Chen (2012). Resistin: functionele rollen en therapeutische overwegingen bij hart- en vaatziekten. British Journal of Pharmacology.
- Ik verzette me. Opgehaald van en.wikipedia.org.
- D.R. Schwartz, M.A. Lazar (2011). Human resistin: Gevonden in vertaling van muis naar mens. Trends in endocrinologie en metabolisme.


Niemand heeft nog op dit artikel gereageerd.