
Vorming, eigenschappen en toepassingen van diazoniumzouten
De diazoniumzouten zijn organische verbindingen waarin er ionische interacties zijn tussen de azogroep (-Ntwee+) en een anion X- (Cl-, F.-, CH3COO-, enz.). De algemene chemische formule is RNtwee+X-, en hierbij kan de zijketen R heel goed een alifatische groep of een arylgroep zijn; d.w.z. een aromatische ring.
De onderste afbeelding geeft de structuur van het arenediazonium-ion weer. De blauwe bollen komen overeen met de azogroep, terwijl de zwarte en witte bollen de aromatische ring van de fenylgroep vormen. De azogroep is erg onstabiel en reactief, omdat een van de stikstofatomen een positieve lading heeft (-N+≡N).
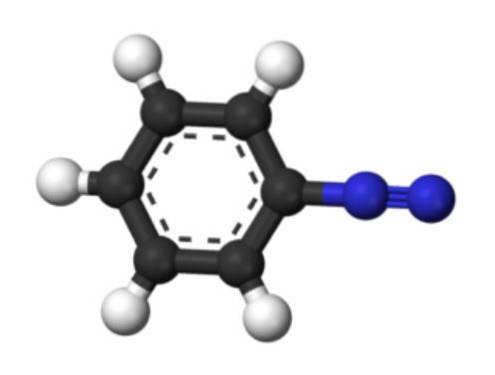
Er zijn echter resonantiestructuren die deze positieve lading delokaliseren, bijvoorbeeld op het aangrenzende stikstofatoom: -N = N+. Dit ontstaat wanneer een paar elektronen dat een binding vormt, naar het stikstofatoom aan de linkerkant gaat.
Evenzo kan deze positieve lading worden gedelokaliseerd door het Pi-systeem van de aromatische ring. Als gevolg hiervan zijn aromatische diazoniumzouten stabieler dan alifatische zouten, aangezien de positieve lading niet kan worden gedelokaliseerd langs een koolstofketen (CH3, CHtweeCH3, enz.).
Artikel index
- 1 Opleiding
- 2 Eigenschappen
- 2.1 Verplaatsingsreacties
- 2.2 Andere verplaatsingen
- 2.3 Redoxreacties
- 2.4 Fotochemische ontleding
- 2.5 Azo-koppelingsreacties
- 3 Toepassingen
- 4 referenties
Opleiding
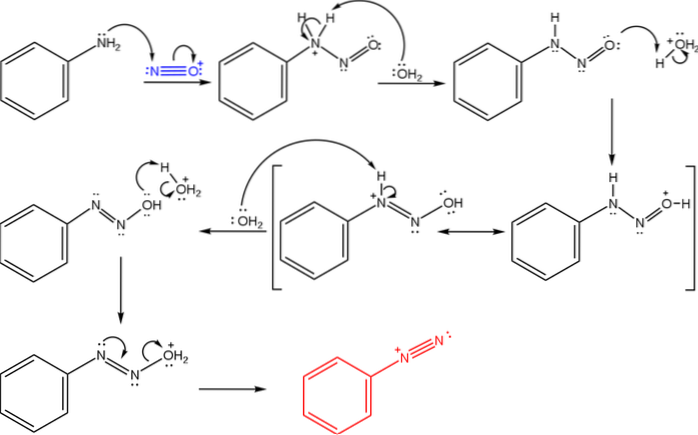
Deze zouten zijn afgeleid van de reactie van een primair amine met een zuurmengsel van natriumnitriet (NaNOtwee.
Secundaire aminen (RtweeNH) en tertiair (R3N) zijn afkomstig van andere stikstofhoudende producten zoals N-nitrosoamines (dit zijn geelachtige oliën), aminezouten (R3HN+X-) en N-nitrosoammoniumverbindingen.
De bovenste afbeelding illustreert het mechanisme waarmee de vorming van diazoniumzouten wordt bepaald, of ook wel bekend als de diazoteringsreactie.
De reactie begint met fenylamine (Ar-NHtwee), die een nucleofiele aanval uitvoert op het N-atoom van het nitrosoniumkation (NO+Dit kation wordt geproduceerd door het mengsel NaNOtwee/ HX, waarbij X in het algemeen Cl is; d.w.z. HCl.
Door de vorming van het nitrosoniumkation komt water vrij in het medium, dat een proton uit de positief geladen stikstof verwijdert..
Dan is hetzelfde watermolecuul (of een andere zure soort anders dan H3OF+) levert een proton op voor zuurstof, waarbij de positieve lading op het minder elektronegatieve stikstofatoom wordt verplaatst).
Nu deprotoneert het water opnieuw de stikstof, waardoor het diazohydroxidemolecuul wordt geproduceerd (het voorlaatste in de reeks).
Omdat het medium zuur is, ondergaat het diazohydroxide dehydratatie van de OH-groep; om elektronische leegstand tegen te gaan, vormt het vrije paar N de drievoudige binding van de azogroep.
Dus aan het einde van het mechanisme, benzeendiazoniumchloride (C.6H.5Ntwee+Cl-, hetzelfde kation uit de eerste afbeelding).
Eigendommen
Over het algemeen zijn diazoniumzouten kleurloos en kristallijn, oplosbaar en stabiel bij lage temperaturen (minder dan 5 ºC)..
Sommige van deze zouten zijn zo gevoelig voor mechanische schokken dat elke fysieke manipulatie ze kan doen ontploffen. Ten slotte reageren ze met water om fenolen te vormen.
Verplaatsingsreacties
Diazoniumzouten zijn mogelijke vrijmakers van moleculaire stikstof, waarvan de vorming de gemeenschappelijke noemer is bij verdringingsreacties. Hierin verdringt een soort X de onstabiele azogroep en ontsnapt als Ntwee(g).
Sandmeyer-reactie
ArNtwee+ + CuCl => ArCl + Ntwee + Cu+
ArNtwee+ + CuCN => ArCN + Ntwee + Cu+
Gatterman reactie
ArNtwee+ + CuX => ArX + Ntwee + Cu+
In tegenstelling tot de Sandmeyer-reactie heeft de Gatterman-reactie metallisch koper in plaats van zijn halogenide; dat wil zeggen, de CuX wordt gegenereerd in situ.
Schiemann-reactie
[ArNtwee+] BF4- => ArF + BF3 + Ntwee
De Schiemann-reactie wordt gekenmerkt door de thermische ontleding van benzeendiazoniumfluorboraat.
Gomberg Bachmann-reactie
[ArNtwee+] Cl- + C6H.6 => Ar - C6H.5 + Ntwee + HCl
Andere verplaatsingen
ArNtwee+ + KI => ArI + K+ + Ntwee
[ArNtwee+] Cl- + H.3POtwee + H.tweeO => C6H.6 + Ntwee + H.3PO3 + HCl
ArNtwee+ + H.tweeO => ArOH + Ntwee + H.+
ArNtwee+ + Stempeltwee => ArNOtwee + Ntwee + Cu+
Redox-reacties
Diazoniumzouten kunnen worden gereduceerd tot arylhydrazines met een mengsel van SnCltwee/ HCl:
ArNtwee+ => ArNHNHtwee
Ze kunnen ook worden gereduceerd tot arylamines in sterkere reducties met Zn / HCl:
ArNtwee+ => ArNHtwee + NH4Cl
Fotochemische ontleding
[ArNtwee+] X- => ArX + Ntwee
Diazoniumzouten zijn gevoelig voor ontbinding door de inval van ultraviolette straling of bij zeer korte golflengten.
Azo-koppelingsreacties
ArNtwee+ + Ar'H → ArNtweeAr '+ H+
Deze reacties zijn misschien wel de meest bruikbare en veelzijdige van de diazoniumzouten. Deze zouten zijn zwakke elektrofielen (de ring delokaliseert de positieve lading van de azogroep). Om te kunnen reageren met aromatische verbindingen, moeten ze negatief geladen zijn, waardoor azos-verbindingen ontstaan..
De reactie vindt plaats met een efficiënte opbrengst tussen een pH van 5 en 7. Bij zure pH is de koppeling lager doordat de azogroep geprotoneerd is, waardoor het onmogelijk is om de negatieve ring aan te vallen..
Evenzo reageert bij basische pH (hoger dan 10) het diazoniumzout met de OH- om diazohydroxide te produceren, dat relatief inert is.
Structuren van dit type organische verbinding hebben een zeer stabiel geconjugeerd Pi-systeem, waarvan de elektronen straling absorberen en uitzenden in het zichtbare spectrum..
Bijgevolg worden azoverbindingen gekenmerkt door hun kleur. Vanwege deze eigenschap worden ze ook wel azokleurstoffen genoemd.
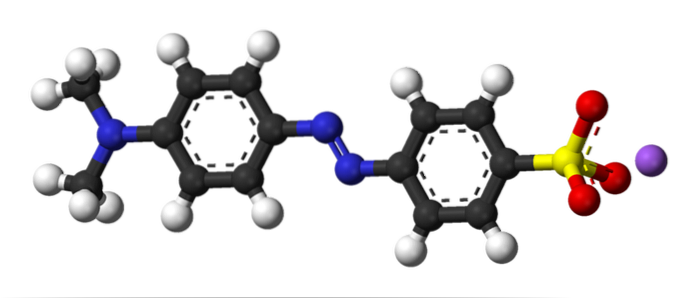
De afbeelding hierboven illustreert het concept van azokoppeling met methyloranje als voorbeeld. In het midden van zijn structuur kan de azogroep worden gezien als het verbindingsstuk van de twee aromatische ringen.
Welke van de twee ringen was de elektrofiel aan het begin van de koppeling? De rechter, omdat de sulfonaatgroep (-SO3) verwijdert de elektronendichtheid uit de ring, waardoor deze nog elektrofieler wordt.
Toepassingen

Een van de meest commerciële toepassingen is de productie van kleurstoffen en pigmenten, die ook de textielindustrie omvat bij het verven van weefsels. Deze azoverbindingen verankeren zich aan specifieke moleculaire plaatsen op het polymeer en kleuren het.
Vanwege zijn fotolytische ontleding wordt het (minder dan voorheen) gebruikt bij de reproductie van documenten. Hoe? De delen van het papier die zijn bedekt met een speciaal plastic, worden verwijderd en vervolgens wordt er een basische oplossing van fenol op aangebracht, waardoor de letters of het ontwerp blauw worden gekleurd..
In organische syntheses worden ze gebruikt als uitgangspunt voor veel aromatische derivaten.
Ten slotte hebben ze toepassingen op het gebied van slimme materialen. Hierin zijn ze covalent gebonden aan een oppervlak (bijvoorbeeld goud), waardoor het een chemische reactie kan geven op externe fysieke prikkels..
Referenties
- Wikipedia. (2018). Diazoniumverbinding. Opgehaald op 25 april 2018, van: en.wikipedia.org
- Francis A. Carey. Organische chemie. Carbonzuren. (zesde editie, pagina's 951-959). Mc Graw Hill.
- Graham Solomons T.W., Craig B. Fryhle. Organische chemie. Amines. (10e editie., Pagina's 935-940). Wiley plus.
- Clark J. (2016). Reacties van diazoniumzouten. Opgehaald op 25 april 2018, van: chemguide.co.uk
- BYJU'S. (5 oktober 2016). Diazoniumzouten en hun toepassingen. Opgehaald op 25 april 2018, van: byjus.com
- TheGlobalTutors. (2008-2015). Eigenschappen van diazoniumzouten. Opgehaald op 25 april 2018, van: theglobaltutors.com
- Ahmad et al. (2015). Polymeer. Opgehaald op 25 april 2018, van: msc.univ-paris-diderot.fr
- Cytochrome T. (15 april 2017). Mechanisme voor de vorming van het benzeendiazoniumion. Opgehaald op 25 april 2018, van: commons.wikimedia.org
- Jacques Kagan. (1993). Organische fotochemie: principes en toepassingen. Academic Press Limited, pagina 71. Opgehaald op 25 april 2018, van: books.google.co.ve



Niemand heeft nog op dit artikel gereageerd.