
Selenium geschiedenis, eigenschappen, structuur, verkrijgen, gebruik
De selenium Het is een niet-metallisch chemisch element dat behoort tot groep 16 van het periodiek systeem en wordt weergegeven door het symbool Se. Dit element heeft tussenliggende eigenschappen tussen zwavel en telluur, die tot dezelfde groep behoren.
Selenium werd in 1817 ontdekt door Jöhs J. Berzelius en John G. Gahn, die bij het verdampen van het pyriet een rood residu waarnamen (onderste afbeelding). Eerst verwarden ze het met tellurium, maar toen realiseerden ze zich dat ze te maken hadden met een nieuw element.

Berzelius noemde het nieuwe element selenium, gebaseerd op de naam "selene" wat "godin van de maan" betekent. Selenium is een essentieel sporenelement voor planten en dieren, hoewel het in hoge concentraties een giftig element is.
Selenium heeft drie allotrope vormen: rood, zwart en grijs. Deze laatste heeft de eigenschap zijn elektrische geleidbaarheid te wijzigen afhankelijk van de intensiteit van het licht dat het uitstraalt (fotogeleider), waarvoor het vele toepassingen heeft gehad.
Selenium wordt wijd verspreid in de aardkorst, maar de mineralen die het bevatten zijn niet overvloedig, dus er is geen winning van selenium.
Het wordt voornamelijk verkregen als bijproduct van het raffinageproces van koperelektrolyse. Selenium hoopt zich op in het slib dat wordt aangetroffen bij de anode van elektrolysecellen.
Mensen bezitten ongeveer 25 selenoproteïnen, waarvan sommige een antioxiderende werking hebben en de vorming van vrije radicalen beheersen. Ook zijn er aminozuren van selenium, zoals selenomethionine en selenocysteïne.
Artikel index
- 1 Geschiedenis
- 1.1 Eerste observatie
- 1.2 Ontdekking
- 1.3 Oorsprong van zijn naam
- 1.4 Uw applicaties ontwikkelen
- 2 Fysische en chemische eigenschappen
- 2.1 Uiterlijk
- 2.2 Standaard atoomgewicht
- 2.3 Atoomnummer (Z)
- 2.4 Smeltpunt
- 2.5 Kookpunt
- 2.6 Dichtheid
- 2.7 Warmte van fusie
- 2.8 Verdampingswarmte
- 2,9 Molaire warmtecapaciteit
- 2.10 oxidatienummers
- 2.11 Elektronegativiteit
- 2.12 Ionisatie-energie
- 2.13 Magnetische volgorde
- 2.14 Hardheid
- 2.15 Isotopen
- 2.16 Allotropie
- 3 Reactiviteit
- 3.1 Reactie met waterstof
- 3.2 Reactie met zuurstof
- 3.3 Reactie met halogenen
- 3.4 Reactie met metalen
- 3.5 Selenieten
- 3.6 Zuren
- 4 Structuur en elektronische configuratie
- 4.1 - Selenium en zijn bindingen
- 4.2 - Ringen of kettingen
- 4.3 - Allotropen
- 5 Waar te vinden en productie
- 5.1 Elektrolyse van koper
- 6 Biologische rol
- 6.1 Tekort
- 6.2 Enzymcofactor
- 6.3 Eiwitten en aminozuren
- 7 Risico's
- 8 toepassingen
- 8.1 Cosmetica
- 8.2 Artsen
- 8.3 Elektrolyse van mangaan
- 8.4 Pigment
- 8.5 Fotogeleider
- 8.6 Kristallen
- 8.7 Vulkanisatie
- 8.8 Legeringen
- 8.9 Gelijkrichters
- 9 referenties
Verhaal
Eerste observatie
De alchemist Arnold de Villanova heeft wellicht in 1230 selenium waargenomen. Hij volgde een opleiding geneeskunde aan de Sorbonne in Parijs, en was zelfs de dokter van paus Clemens V.
Villanova in zijn boek Rosarium Philosophorum beschrijft een rode zwavel of "zwavel rebeum" die in een oven was achtergelaten na het verdampen van de zwavel. Deze rode zwavel kan een allotroop van selenium zijn geweest.
Ontdekking
In 1817 ontdekten Jöhs Jakob Berzelius en John Gottlieb Gahn selenium in een chemische fabriek voor de productie van zwavelzuur, nabij Gripsholm, Zweden. De grondstof voor het maken van het zuur was pyriet, dat werd gewonnen uit een Falun-mijn..
Berzelius werd getroffen door het bestaan van een rood residu dat in de loden container was achtergebleven nadat de zwavel was verbrand.
Berzelius en Gahn merkten ook op dat het rode residu een sterke mierikswortelgeur had, vergelijkbaar met die van telluur. Daarom schreef hij aan zijn vriend Marect dat ze geloofden dat de waargenomen afzetting een telluurverbinding was..
Berselius ging echter door met het analyseren van het materiaal dat was afgezet toen het pyriet werd verbrand en heroverwoog dat er geen tellurium was gevonden in de Falun-mijn. Hij concludeerde in februari 1818 dat hij een nieuw element had ontdekt.
Oorsprong van de naam
Berzelius wees erop dat het nieuwe element een combinatie was van zwavel en telluur, en dat de gelijkenis van tellurium met het nieuwe element hem de gelegenheid had gegeven om de nieuwe stof selenium te noemen..
Berzelius legde uit dat "tellus" godin van de aarde betekent. Martin Klaport gaf deze naam in 1799 aan tellurium en schreef: “Geen enkel element wordt zo genoemd. Het moest gedaan worden! ".
Vanwege de gelijkenis van tellurium met de nieuwe substantie, noemde Berzelius het met het woord selenium, afgeleid van het Griekse woord "selene" wat "godin van de maan" betekent..
Ontwikkeling van uw applicaties
In 1873 ontdekte Willoughby Smith dat de elektrische geleidbaarheid van selenium afhing van het licht dat het uitstraalde. Door deze eigenschap kon selenium tal van toepassingen hebben.
Alexander Graham Bell gebruikte in 1979 selenium in zijn fotofoon. Selenium produceert een elektrische stroom die evenredig is met de intensiteit van het licht dat het verlicht, en wordt gebruikt in lichtmeters, beveiligingsmechanismen voor het openen en sluiten van deuren, enz..
Het gebruik van seleniumgelijkrichters in de elektronica begon in de jaren dertig van de vorige eeuw, met tal van commerciële toepassingen. In de jaren zeventig werd het in gelijkrichters vervangen door silicium.
In 1957 werd ontdekt dat selenium een essentieel element was voor het leven van zoogdieren, aangezien het aanwezig was in enzymen die beschermen tegen reactieve zuurstof en vrije radicalen. Bovendien werd het bestaan van aminozuren zoals selenomethionine ontdekt.
Fysische en chemische eigenschappen
Uiterlijk
Omdat er verschillende allotropen zijn voor selenium, varieert het fysieke uiterlijk. Komt meestal voor als een roodachtige vaste stof in poedervorm.
Standaard atoomgewicht
78.971 u
Atoomnummer (Z)
3. 4
Smeltpunt
221 ºC
Kookpunt
685 ºC
Dichtheid
De dichtheid van selenium varieert afhankelijk van welke allotroop of polymorf wordt overwogen. Enkele van de dichtheden bepaald bij kamertemperatuur zijn:
Grijs: 4,819 g / cm3
Alpha: 4,39 g / cm3
Glasachtig: 4,28 g / cm3
Vloeibare toestand (smeltpunt): 3,99 g / cm3
Warmte van fusie
Grijs: 6,69 kJ / mol
Warmte van verdamping
95,48 kJ / mol
Molaire warmtecapaciteit
25.363 J / (mol K)
Oxidatienummers
Selenium kan binden in zijn verbindingen en manifesteert de volgende getallen of oxidatietoestanden: -2, -1, +1, +2, +3, +4, +5, +6. Van alle zijn de belangrijkste -2 (Setwee-), +4 (Se4+) en +6 (Se6+.
Bijvoorbeeld in de SeOtwee selenium heeft een oxidatiegetal van +4; dat wil zeggen, het bestaan van het kation Se wordt aangenomen4+ (Ik weet4+OFtweetwee-Evenzo met SeO3 selenium heeft een oxidatiegetal van +6 (Se6+OF3twee-.
In waterstofselenide, H.tweeSe, selenium heeft een oxidatiegetal van -2; dat wil zeggen, nogmaals, het bestaan van het ion of anion Se wordt aangenomentwee- (H.twee+ik weettwee-Dit komt omdat selenium elektronegatiever is dan waterstof..
Elektronegativiteit
2,55 op de schaal van Pauling.
Ionisatieenergie
-Ten eerste: 941 kJ / mol.
-Ten tweede: 2.045 kJ / mol.
-Ten derde: 2.973,7 kJ / mol.
Magnetische volgorde
Diamagnetisch.
Hardheid
2.0 op de schaal van Mohs.
Isotopen
Er zijn vijf natuurlijke en stabiele isotopen van selenium, die hieronder worden weergegeven met hun respectieve hoeveelheden:
-74Se (0,86%)
-76Se (9,23%)
-77Se (7,6%)
-78Se (23,69%)
-80Se (49,8%)
Allotropie

Selenium bereid in chemische reacties is een steenrood amorf poeder, dat bij snel smelten aanleiding geeft tot de glasachtige zwarte vorm, vergelijkbaar met rozenkransparels (bovenste afbeelding). Black Selenium is een broze en glanzende vaste stof.
Ook is zwart selenium enigszins oplosbaar in koolstofsulfide. Wanneer deze oplossing wordt verwarmd tot 180 ºC, slaat grijs selenium neer, de meest stabiele en dichte allotroop..
Grijs selenium is bestand tegen oxidatie en is inert tegen de werking van niet-oxiderende zuren. De belangrijkste eigenschap van dit selenium is de fotogeleiding. Bij belichting neemt de elektrische geleidbaarheid met een factor 10 tot 15 keer toe.
Reactiviteit
Selenium in zijn verbindingen komt voor in de oxidatietoestanden -2, +4 en +6. Het vertoont een duidelijke neiging om zuren te vormen in de hogere oxidatietoestanden. Verbindingen met selenium met oxidatietoestand -2 worden seleniden genoemd (Setwee-.
Reactie met waterstof
Selenium reageert met waterstof om waterstofselenide te vormen (H.tweeSe), een kleurloos, brandbaar en onwelriekend gas.
Reactie met zuurstof
Selenium verbrandt een blauwe vlam en vormt seleniumdioxide:
ik weet8 (s) + 8 Otwee => 8 SeOtwee (s)
Seleniumoxide is een vaste, witte, polymere stof. Zijn hydratatie produceert seleenzuur (H.tweeSeO3Ook selenium vormt seleniumtrioxide (SeO3), analoog aan zwavel (SO3.
Reactie met halogenen
Selenium reageert met fluor om seleniumhexafluoride te vormen:
ik weet8 (s) + 24 F.twee (g) => 8 SeF6 (l)
Selenium reageert met chloor en broom om respectievelijk disileniumdichloride en dibromide te vormen:
ik weet8 (s) + 4 Cltwee => 4 SetweeCltwee
ik weet8 (s) + 4 Brtwee => 4 SetweeBrtwee
Selenium kan ook SeF vormen4 en SeCl4.
Aan de andere kant vormt selenium verbindingen waarin een seleniumatoom samenkomt met een van halogeen en een andere van zuurstof. Een belangrijk voorbeeld is selenium oxychloride (SeOtweeCltwee), met selenium in oxidatietoestand +6, een extreem krachtig oplosmiddel.
Reactie met metalen
Selenium reageert met metalen om seleniden van aluminium, cadmium en natrium te vormen. De onderstaande chemische vergelijking komt overeen met die voor de vorming van aluminiumselenide:
3 Se8 + 16 Al => 8 Altweeik weet3
Selenieten
Selenium vormt zouten die bekend staan als selenieten; bijvoorbeeld: zilverseleniet (AgtweeSeO3) en natriumseleniet (NatweeSeO3Deze naam is in literaire context gebruikt om te verwijzen naar de bewoners van de maan: de selenieten.
Zuren
Het belangrijkste zuur in selenium is seleninezuur (H.tweeSeO4Het is zo sterk als zwavelzuur en wordt gemakkelijker gereduceerd.
Structuur en elektronische configuratie
- Selenium en zijn links
Selenium heeft zes valentie-elektronen en bevindt zich daarom in groep 16, hetzelfde als zuurstof en zwavel. Deze zes elektronen bevinden zich in de 4s- en 4p-orbitalen, volgens hun elektronische configuratie:
[Ar] 3d10 4stwee 4p4
Het heeft daarom, net als zwavel, twee covalente bindingen nodig om zijn valentie-octet te voltooien; hoewel het de beschikbaarheid heeft van zijn 4d-orbitalen om te binden met meer dan twee atomen. Zo komen drie seleniumatomen samen en vormen twee covalente bindingen: Se-Se-Se.
Selenium met zijn hoogste atomaire massa heeft de natuurlijke neiging om structuren te vormen die worden beheerst door covalente bindingen; in plaats van gerangschikt te zijn als twee atomen moleculen Setwee, Se = Se, analoog aan Otwee, O = O.
- Ringen of kettingen
Onder de moleculaire structuren die seleniumatomen aannemen, kunnen er twee in algemene termen worden genoemd: ringen of ketens. Merk op dat in het hypothetische geval van Se3, de Se-atomen aan de uiteinden hebben nog steeds elektronen nodig; daarom moeten ze achtereenvolgens aan andere atomen worden gebonden totdat de ketting in een ring kan worden gesloten.
De meest voorkomende ringen zijn de achtledige ringen of atomen van selenium:8 (een selenietkroon). Waarom acht? Omdat hoe kleiner de ring, hoe meer stress hij zal lijden; dat wil zeggen, de hoeken van hun banden wijken af van de natuurlijke waarden bepaald door hun sp hybridisaties3 (vergelijkbaar met cycloalkanen).
Aangezien er acht atomen zijn, is de scheiding tussen de Se-Se-atomen voldoende zodat hun bindingen "ontspannen" en niet "gebogen" zijn; hoewel de hoek van de schakels 105,7º is en niet 109,5º. Aan de andere kant kunnen er kleinere ringen zijn:6 en7.
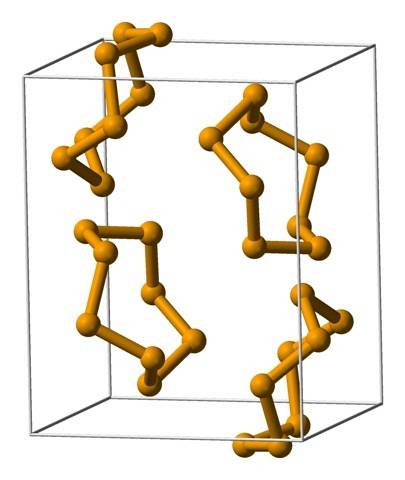
De bovenste afbeelding toont de Se ring-eenheden.8. Let op de gelijkenis die ze hebben met de zwavelkronen; alleen zijn ze groter en zwaarder.
Naast ringen kunnen seleniumatomen ook in spiraalvormige ketens worden gerangschikt (denk aan wenteltrappen):
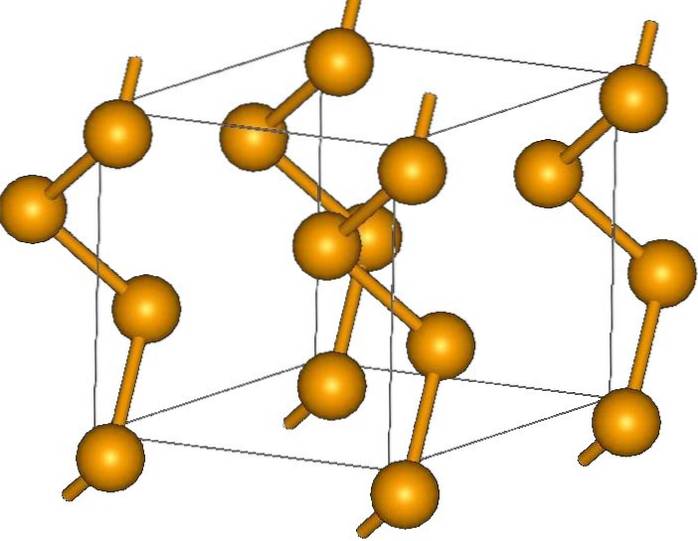
Aan de uiteinden kunnen er terminale dubbele bindingen (-Se = Se) of Se-ringen zijn8.
- Allotropen
Rekening houdend met het feit dat er spiraalvormige ringen of ketens van selenium kunnen zijn, en dat hun afmetingen ook kunnen variëren afhankelijk van het aantal atomen dat ze bevatten, dan is het duidelijk dat er meer dan één allotroop voor dit element is; dat wil zeggen pure selenium vaste stoffen maar met verschillende moleculaire structuren.
Rood selenium
Onder de meest prominente allotropen van selenium hebben we rood, dat kan verschijnen als een amorf poeder, of als monokliene en polymorfe kristallen (zie afbeelding van Se8.
In amorf rood selenium zijn de structuren ongeordend, zonder duidelijke patronen; terwijl in de lens de ringen een monokliene structuur tot stand brengen. Rood kristallijn selenium is polymorf en heeft drie fasen: α, β en γ, die verschillen in dichtheid..
Zwart selenium
De structuur van zwart selenium bestaat ook uit ringen; maar niet uit acht leden, maar uit veel meer, die tot ringen van duizend atomen reiken (Se1000Er wordt dan gezegd dat de structuur ervan complex is en uit polymere ringen bestaat; sommige groter of kleiner dan andere.
Aangezien er polymere ringen van verschillende afmetingen zijn, is het moeilijk te verwachten dat ze een structurele orde bepalen; dus het zwarte selenium is ook amorf, maar in tegenstelling tot het hierboven genoemde roodachtige poeder heeft het een glazige textuur, hoewel het broos is.
Grijs selenium
En tot slot, een van de eenvoudigste allotropen van selenium is grijs, dat boven de andere uitsteekt omdat het het meest stabiel is onder normale omstandigheden en ook een metaalachtig uiterlijk heeft..
De kristallen kunnen hexagonaal of trigonaal zijn, bepaald door de Londense dispersiekrachten tussen de polymere spiraalvormige ketens (bovenste afbeelding). De hoek van hun bindingen is 130,1º, wat duidt op een positieve afwijking van de tetraëdrische omgeving (met hoeken van 109,5º)..
Dat is de reden waarom selenium spiraalvormige ketens de indruk wekken "open" te zijn. Ter verduidelijking: in deze structuur staan de atomen tegenover elkaar, dus in theorie moet er een grotere overlap van hun orbitalen zijn om geleidingsbanden te creëren..
De hitte met de toename van de moleculaire trillingen beschadigt deze banden wanneer de ketens ontregeld raken; terwijl de energie van een foton direct de elektronen beïnvloedt, ze opwekt en hun transacties bevordert. Vanuit dit gezichtspunt is het "gemakkelijk" om de fotogeleiding voor grijs selenium voor te stellen..
Waar het zich bevindt en productie
Hoewel selenium wijdverspreid is, is het een zeldzaam element. Het wordt in zijn oorspronkelijke staat aangetroffen en wordt geassocieerd met zwavel en mineralen zoals eucairiet (CuAgSe), claustaliet (PbSe), naumaniet (AgtweeSe) en crookesite [(CuTiAg)tweeIk weet].
Selenium wordt gevonden als een onzuiverheid die zwavel vervangt in een klein deel van de zwavelhoudende mineralen van metalen; zoals koper, lood, zilver, etc..
Er zijn bodems waarin selenium voorkomt in de oplosbare vorm van selenaten. Deze worden door het regenwater naar de rivieren vervoerd en vandaar naar de oceaan.
Sommige planten kunnen selenium opnemen en concentreren. Een kopje paranoten bevat bijvoorbeeld 544 µg selenium, een hoeveelheid die overeenkomt met 777% van de dagelijks aanbevolen hoeveelheid selenium..
Bij levende wezens wordt selenium aangetroffen in sommige aminozuren, zoals: selenomethionine, selenocysteïne en methylselenocysteïne. Selenocysteïne en seleniet worden gereduceerd tot waterstofselenide.
Elektrolyse van koper
Er is geen winning van selenium. Het meeste wordt verkregen als een bijproduct van het raffinageproces van koperelektrolyse en wordt aangetroffen in het slib dat zich ophoopt aan de anode..
De eerste stap is de productie van seleniumdioxide. Hiervoor wordt het anodische slib behandeld met natriumcarbonaat om zijn oxidatie te produceren. Vervolgens wordt water aan seleniumoxide toegevoegd en het wordt aangezuurd om seleniumzuur te vormen..
Ten slotte wordt seleenzuur behandeld met zwaveldioxide om het te verminderen en elementair selenium te verkrijgen..
Bij een andere methode wordt in het mengsel van slib en slib gevormd bij de productie van zwavelzuur een onzuiver rood seleen verkregen dat oplost in zwavelzuur..
Vervolgens worden seleenzuur en seleenzuur gevormd. Dit seleniumzuur krijgt dezelfde behandeling als de vorige methode.
Chloor, dat inwerkt op metaalseleniden, kan ook worden gebruikt om vluchtige gechloreerde seleniumverbindingen te produceren; zoals: SetweeCltwee, SeCl4, SeCltwee en SeOCltwee.
Deze verbindingen worden in een proces dat in water wordt uitgevoerd, omgezet in seleenzuur, dat wordt behandeld met zwaveldioxide om het selenium vrij te maken..
Biologische rol
Tekort
Selenium is een essentieel sporenelement voor planten en dieren, bij wie het tekort bij de mens ernstige aandoeningen heeft veroorzaakt, zoals de ziekte van Keshan; een ziekte die wordt gekenmerkt door schade aan het myocardium.
Bovendien wordt seleniumtekort geassocieerd met mannelijke onvruchtbaarheid en kan het een rol spelen bij de ziekte van Kashin-Beck, een type artrose. Ook is seleniumtekort waargenomen bij reumatoïde artritis.
Enzym cofactor
Selenium is een bestanddeel van enzymen met antioxiderende werking, zoals glutathionperoxidase en thioredoxinereductase die stoffen met reactieve zuurstof elimineren..
Bovendien is selenium een cofactor van dejodinasen van het schildklierhormoon. Deze enzymen zijn belangrijk bij het reguleren van de werking van schildklierhormonen..
Het gebruik van selenium is gemeld bij de behandeling van de ziekte van Hasimoto, een auto-immuunziekte waarbij antilichamen tegen schildkliercellen worden gevormd..
Selenium is ook gebruikt om de toxische effecten van kwik te verminderen, aangezien sommige van de effecten ervan worden uitgeoefend op seleniumafhankelijke antioxidant-enzymen..
Eiwitten en aminozuren
De mens heeft ongeveer 25 selenoproteïnen die een antioxiderende werking uitoefenen ter bescherming tegen oxidatieve stress, geïnitieerd door een overmaat aan reactieve zuurstofsoorten (ROS) en reactieve stikstofsoorten (NOS)..
De aanwezigheid van de aminozuren selenomethiocine en selenocysteïne is bij mensen waargenomen. Selenomethionine wordt gebruikt als voedingssupplement bij de behandeling van seleniumtekort.
Risico's
Een hoge lichaamsconcentratie van selenium kan tal van schadelijke effecten hebben op de gezondheid, te beginnen met broos haar en broze nagels, tot huiduitslag, hitte, oedeem van de huid en ernstige pijn.
Bij de behandeling van selenium in contact met de ogen, kunnen mensen branderig, geïrriteerd en tranen ervaren. Ondertussen kan langdurige blootstelling aan rook met een hoog seleniumgehalte longoedeem, knoflookadem en bronchitis veroorzaken..
Bovendien kan de persoon last krijgen van longontsteking, misselijkheid, koude rillingen, koorts, keelpijn, diarree en hepatomegalie..
Selenium kan een wisselwerking hebben met andere medicijnen en voedingssupplementen, zoals maagzuurremmers, antineoplastische geneesmiddelen, corticosteroïden, niacine en anticonceptiepillen..
Selenium is in verband gebracht met een verhoogd risico op huidkanker. Een studie van het National Cancer Institute wees uit dat mannen met een hoog seleniumgehalte in het lichaam twee keer zoveel kans hadden op agressieve prostaatkanker.
Een studie geeft aan dat de dagelijkse inname van 200 µg selenium de kans op het ontwikkelen van diabetes type II met 50% vergroot.
Toepassingen
Cosmetica
Seleniumsulfide wordt gebruikt bij de behandeling van seborroe, evenals bij vettig haar of roos.
Artsen
Het wordt gebruikt als alternatief geneesmiddel bij de behandeling van de ziekte van Hasimoto, een auto-immuunziekte van de schildklier.
Selenium vermindert de toxiciteit van kwik, een van zijn toxische activiteiten wordt uitgeoefend op deoxiderende enzymen, die selenium als cofactor gebruiken.
Mangaan-elektrolyse
Het gebruik van seleniumoxide bij de elektrolyse van mangaan verlaagt de kosten van de techniek aanzienlijk, aangezien het het elektriciteitsverbruik vermindert.
Pigment
Selenium wordt gebruikt als pigment in verven, kunststoffen, keramiek en glas. Afhankelijk van het gebruikte selenium varieert de kleur van het glas van dieprood tot lichtoranje..
Fotogeleidend
Omdat grijs selenium de eigenschap heeft om zijn elektrische geleidbaarheid te veranderen als functie van de intensiteit van het licht dat het uitstraalt, is selenium gebruikt in fotokopieerapparaten, fotocellen, fotometers en zonnecellen..
Het gebruik van selenium in fotokopieerapparaten was een van de belangrijkste toepassingen van selenium; maar door het verschijnen van organische fotogeleiders wordt het gebruik ervan afgenomen.
Kristallen
Selenium wordt gebruikt voor het verkleuren van glas, door de aanwezigheid van ijzer dat een groene of gele verkleuring geeft. Bovendien laat het een rode verkleuring van het glas toe, afhankelijk van het gebruik dat u het wilt geven..
Vulkanisatie
Diethyldithiocarbonaatselenium wordt gebruikt als vulkanisatiemiddel in rubberproducten.
Legeringen
Selenium wordt gebruikt in combinatie met bismut in messing om lood te vervangen; Zeer giftig element waarvan het gebruik is afgenomen vanwege de aanbevelingen van gezondheidsorganisaties.
Selenium wordt in lage concentraties toegevoegd aan staal en koperlegeringen om de bruikbaarheid van deze metalen te verbeteren..
Gelijkrichters
Selenium-gelijkrichters werden in 1933 gebruikt tot de jaren 70, toen ze werden vervangen door silicium vanwege de lage kosten en superieure kwaliteit..
Referenties
- Royal Australian Chemical Institute. (2011). Selenium. [Pdf]. Hersteld van: raci.org.au
- Wikipedia. (2019). Selenium. Hersteld van: en.wikipedia.org
- Sato Kentaro. (s.f.). Nieuwe allotropen van hoofdgroepselementen. [Pdf]. Hersteld van: tcichemicals.com
- Dr. Dough Stewart. (2019). Selenium Element Feiten. Chemicool. Hersteld van: chemicool.com
- Robert C. Brasted. (28 augustus 2019). Selenium. Encyclopædia Britannica. Hersteld van: britannica.com
- Markies Miguel. (s.f.). Selenium. Hersteld van: nautilus.fis.uc.pt
- Helmenstine, Anne Marie, Ph.D. (3 juli 2019). Selenium Feiten. Hersteld van: thoughtco.com
- Lenntech B. V. (2019). Periodiek systeem: selenium. Hersteld van: lenntech.com
- Tinggi U. (2008). Selenium: zijn rol als antioxidant in de menselijke gezondheid. Milieugezondheid en preventieve geneeskunde, 13(2), 102-108. doi: 10.1007 / s12199-007-0019-4
- Bureau voor voedingssupplementen. (9 juli 2019). Selenium: informatieblad voor gezondheidswerkers. Nationaal gezondheidsinstituut. Hersteld van: ods.od.nih.gov



Niemand heeft nog op dit artikel gereageerd.