
Esters eigenschappen, structuur, gebruik, voorbeelden
De esters Het zijn organische verbindingen met een carbonzuurcomponent en een alcoholcomponent. De algemene chemische formule is RCOtweeR of RCOOR. De rechterkant, RCOO, komt overeen met de carboxylgroep, terwijl de rechterkant, OR het is alcohol. De twee delen een zuurstofatoom en vertonen enige gelijkenis met ethers (ROR ').
Om deze reden ethylacetaat, CH3COOCHtweeCH3, de eenvoudigste van de esters, werd beschouwd als de azijnzuur of azijnether, en vandaar de etymologische oorsprong van de naam 'ester'. Een ester bestaat dus uit de vervanging van de zure waterstof van de COOH-groep door een alkylgroep uit een alcohol.

Waar worden esters gevonden? Van bodems tot organische chemie, de natuurlijke bronnen zijn talrijk. De aangename geur van fruit, zoals bananen, peren en appels, is het product van de interactie van esters met vele andere componenten. Ze worden ook aangetroffen in de vorm van triglyceriden in oliën of vetten.
Ons lichaam maakt triglyceriden uit vetzuren, die lange koolstofketens hebben, en glycerolalcohol. Wat sommige esters van andere onderscheidt, zit in zowel R, de keten van de zuurcomponent, als R ', die van de alcoholische component..
Een ester met een laag molecuulgewicht moet weinig koolstofatomen hebben in R en R ', terwijl andere, zoals wassen, veel koolstofatomen hebben, vooral in R', de alcoholische component, en dus een hoog molecuulgewicht..
Niet alle esters zijn echter strikt biologisch. Als het koolstofatoom van de carbonylgroep wordt vervangen door een van fosfor, dan hebben we RPOOR '. Dit staat bekend als een fosfaatester, en ze zijn van cruciaal belang in de structuur van DNA..
Zolang een atoom dus efficiënt kan binden aan koolstof of zuurstof, zoals zwavel (RSOOR '), kan het bijgevolg een anorganische ester vormen.
Artikel index
- 1 Eigenschappen
- 1.1 Oplosbaarheid in water
- 1.2 Hydrolysereactie
- 1.3 Reductiereactie
- 1.4 Omesteringsreactie
- 2 Structuur
- 2.1 Waterstofbindingsacceptor
- 3 Nomenclatuur
- 4 Hoe worden ze gevormd?
- 4.1 Verestering
- 4.2 Esters van acylchloriden
- 5 toepassingen
- 6 voorbeelden
- 7 referenties
Eigendommen
Esters zijn geen zuren of alcoholen, dus gedragen ze zich niet als zodanig. Hun smelt- en kookpunten zijn bijvoorbeeld lager dan die met vergelijkbare molecuulgewichten, maar liggen dichter bij die van aldehyden en ketonen..
Butaanzuur, CH3CHtweeCHtweeCOOH heeft een kookpunt van 164 ° C, terwijl ethylacetaat, CH3COOCHtweeCH3, van 77,1ºC.
Afgezien van het recente voorbeeld, de kookpunten van 2-methylbutaan, CH3CH (CH3) CHtweeCH3, van methylacetaat, CH3COOCH3, en 2-butanol, CH3,CH (OH) CHtweeCH3, ze zijn als volgt: 28, 57 en 99 ° C. Alle drie de verbindingen hebben molecuulgewichten van 72 en 74 g / mol..
Esters met een laag molecuulgewicht zijn meestal vluchtig en hebben een aangename geur, daarom geeft hun gehalte aan fruit ze hun vertrouwde geur. Aan de andere kant, wanneer hun molecuulgewichten hoog zijn, zijn ze kleurloze en reukloze kristallijne vaste stoffen, of vertonen ze, afhankelijk van hun structuur, vettige eigenschappen..
Oplosbaarheid in water
Carbonzuren en alcoholen zijn meestal oplosbaar in water, tenzij ze een sterk hydrofoob karakter hebben in hun moleculaire structuren. Hetzelfde geldt voor esters. Wanneer R of R 'korte ketens zijn, kan de ester een interactie aangaan met watermoleculen via dipool-dipoolkrachten en Londense krachten..
Dit komt omdat esters acceptoren van waterstofbindingen zijn. Hoe? Door zijn twee zuurstofatomen RCOOR '. Watermoleculen vormen waterstofbruggen met elk van deze zuurstofatomen. Maar als de R- of R'-ketens erg lang zijn, stoten ze het water in hun omgeving af, waardoor het onmogelijk wordt om op te lossen..
Een duidelijk voorbeeld hiervan doet zich voor met triglyceride-esters. De zijketens zijn lang en maken oliën en vetten onoplosbaar in water, tenzij ze in contact komen met een minder polair oplosmiddel, meer verwant aan deze ketens..
Hydrolysereactie
Esters kunnen ook reageren met watermoleculen in een zogenaamde hydrolysereactie. Ze hebben echter een voldoende zuur of basisch medium nodig om het mechanisme van genoemde reactie te bevorderen:
RCOOR ' + H.tweeOF <=> RCOOh + R'OH.
(Zuur medium)
Het watermolecuul voegt zich bij de carbonylgroep, C = O. Zure hydrolyse wordt samengevat in de vervanging van elke R 'van de alcoholische component door een OH uit water. Merk ook op hoe de ester "breekt" in zijn twee componenten: het carbonzuur, RCOOH, en de alcohol R'OH..
RCOOR ' + Oh- => RCOOF- + R'OH.
(Basismedium)
Wanneer hydrolyse wordt uitgevoerd in een basismedium, treedt een onomkeerbare reactie op die bekend staat als verzeping. Dit wordt veel gebruikt en vormt de hoeksteen bij de productie van artisanale of industriële zepen..
Het RCOO- is het stabiele carboxylaatanion, dat zich elektrostatisch associeert met het overheersende kation in het medium.
Als de gebruikte base NaOH is, wordt het RCOONa-zout gevormd. Wanneer de ester een triglyceride is, dat per definitie drie R-zijketens heeft, worden drie vetzuurzouten gevormd, RCOONa, en de alcohol glycerol.
Reductiereactie
Esters zijn sterk geoxideerde verbindingen. Wat betekent het? Het betekent dat het verschillende covalente bindingen heeft met zuurstof. Door het elimineren van de C-O-bindingen ontstaat er een breuk die de zure en alcoholische componenten scheidt; Bovendien wordt het zuur gereduceerd tot een minder geoxideerde vorm, tot een alcohol:
RCOOR '=> RCHtweeOH + R'OH
Dit is de reductiereactie. Er is een sterk reductiemiddel nodig, zoals lithiumaluminiumhydride, LiAlH4, en van een zuur medium dat de migratie van elektronen bevordert. Alcoholen zijn de kleinste vormen, dat wil zeggen die met de minst covalente bindingen met zuurstof (slechts één: C-OH).
De twee alcoholen, RCHtweeOH + R'OH, zijn afkomstig van de twee respectievelijke ketens van de originele RCOOR'-ester. Dit is een methode voor de synthese van alcoholen met toegevoegde waarde uit hun esters. Als je bijvoorbeeld alcohol wilt maken van een exotische bron van esters, is dit een goede route voor dat doel..
Omesteringsreactie
Esters kunnen in andere worden omgezet als ze in zure of basische omgevingen reageren met alcoholen:
RCOOR ' + R "OH <=> RCOOF " + R'OH.
Structuur
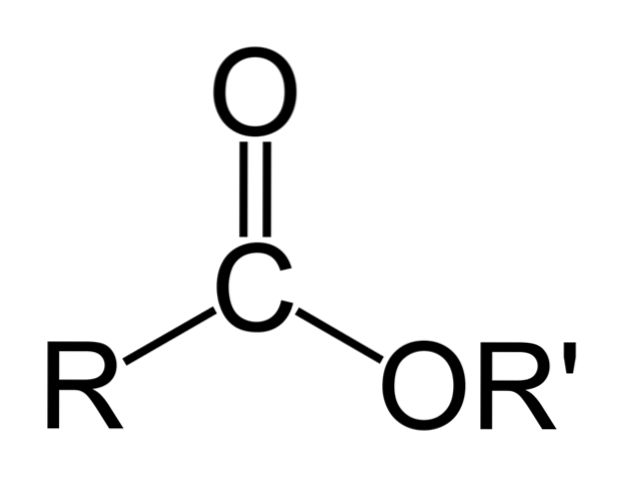
De bovenste afbeelding geeft de algemene structuur van alle organische esters weer. Merk op dat R, de carbonylgroep C = O, en OR ', een platte driehoek vormen, product van sp-hybridisatietwee van het centrale koolstofatoom. De andere atomen kunnen echter andere geometrieën aannemen en hun structuren hangen af van de intrinsieke aard van R of R '.
Als R of R 'eenvoudige alkylketens zijn, bijvoorbeeld van het type (CHtweenCH3, deze zullen zigzaggend in de ruimte verschijnen. Dit is het geval met pentylbutanoaat, CH3CHtweeCHtweeCOOCHtweeCHtweeCHtweeCHtweeCH3.
Maar in elk van de koolstofatomen van deze ketens kon een vertakking of onverzadiging worden gevonden (C = C, C≡C), die de globale structuur van de ester zou wijzigen. En om deze reden variëren de fysische eigenschappen, zoals oplosbaarheid en het kook- en smeltpunt van elke verbinding..
Onverzadigde vetten hebben bijvoorbeeld dubbele bindingen in hun R-ketens, die intermoleculaire interacties negatief beïnvloeden. Als gevolg hiervan dalen hun smeltpunten, totdat ze bij kamertemperatuur vloeibaar zijn, of oliën..
Waterstofbindingsacceptor
Hoewel de driehoek van het esterskelet meer opvalt in de afbeelding, zijn het de R- en R'-ketens die verantwoordelijk zijn voor de diversiteit in hun structuren.
De driehoek verdient echter wel een structureel kenmerk van esters: het zijn acceptoren van waterstofbruggen. Hoe? Door de zuurstof van de carbonyl- en alkoxidegroepen (de -OR ').
Deze hebben paren vrije elektronen, die gedeeltelijk positief geladen waterstofatomen uit watermoleculen kunnen aantrekken..
Daarom is het een speciaal type dipool-dipool-interacties. De watermoleculen naderen de ester (indien niet voorkomen door de R- of R'-ketens) en de C = O-H-bruggen worden gevormdtweeO of OHtwee-O-R '.
Nomenclatuur
Hoe worden esters genoemd? Om een ester correct te benoemen, moet rekening worden gehouden met de koolstofgetallen van de R- en R'-ketens. Evenzo mogelijke vertakkingen, substituenten of onverzadigingen.
Zodra dit is gebeurd, wordt aan de naam van elke R 'van de alkoxidegroep -OR' het achtervoegsel -yl toegevoegd, terwijl aan de keten R van de carboxylgroep -COOR het achtervoegsel -aat wordt toegevoegd. Sectie R wordt eerst genoemd, gevolgd door het woord 'van' en vervolgens de naam van sectie R '.
Bijvoorbeeld de CH3CHtweeCHtweeCOOCHtweeCHtweeCHtweeCHtweeCH3 Het heeft vijf koolstofatomen aan de rechterkant, dat wil zeggen, ze komen overeen met R '. En aan de linkerkant bevinden zich vier koolstofatomen (inclusief de carbonylgroep C = O). Daarom is R 'een pentylgroep en R een butaan (om de carbonylgroep op te nemen en de hoofdketen te beschouwen).
Dus om de verbinding een naam te geven, voegt u gewoon de overeenkomstige achtervoegsels toe en noemt u ze in de juiste volgorde: butaangebonden door pentI Lo.
Hoe de volgende verbinding te noemen: CH3CHtweeCOOC (CH33? De tekenreeks -C (CH33 komt overeen met de tert-butylalkylsubstituent. Omdat de linkerkant drie koolstofatomen heeft, is het een ‘propaan’. Zijn naam is dan: propaangebonden door tert-butI Lo.
Hoe worden ze gevormd?
Verestering
Er zijn veel routes om ester te synthetiseren, waarvan sommige zelfs nieuw kunnen zijn. Ze komen echter allemaal overeen met het feit dat de driehoek in het beeld van de structuur moet worden gevormd, dat wil zeggen de CO-O-binding. Hiervoor moet u uitgaan van een verbinding die voorheen de carbonylgroep had: zoals een carbonzuur.
En waar moet carbonzuur aan binden? Voor een alcohol, anders zou het niet de alcoholische component hebben die esters kenmerkt. Carbonzuren hebben echter warmte en zuur nodig om het reactiemechanisme te laten verlopen. De volgende chemische vergelijking vertegenwoordigt het bovenstaande:
RCOOH + R'OH <=> RCOOR '+ HtweeOF
(Zuur medium)
Dit staat bekend als de verestering.
Vetzuren kunnen bijvoorbeeld worden veresterd met methanol, CH3OH, om zijn zure H te vervangen door methylgroepen, dus deze reactie kan ook worden beschouwd als methylering. Dit is een belangrijke stap bij het bepalen van het vetzuurprofiel van bepaalde oliën of vetten..
Esters van acylchloriden
Een andere manier om esters te synthetiseren is van acylchloriden, RCOCl. In hen is in plaats van een OH-hydroxylgroep te substitueren, het Cl-atoom gesubstitueerd:
RCOCl + R'OH => RCOOR '+ HCl
En in tegenstelling tot de verestering van een carbonzuur komt er geen water vrij maar zoutzuur.
Andere methoden zijn beschikbaar binnen de wereld van de organische chemie, zoals de Baeyer-Villiger-oxidatie, waarbij gebruik wordt gemaakt van peroxyzuren (RCOOOH)..
Toepassingen

Tot de belangrijkste toepassingen van esters behoren:
-Bij het maken van kaarsen of taps toelopende delen, zoals in de afbeelding hierboven. Hiervoor worden zeer lange zijketenesters gebruikt..
-Als conserveringsmiddelen voor medicijnen of voedingsmiddelen. Dit komt door de werking van parabenen, die niets meer zijn dan esters van para-hydroxybenzoëzuur. Hoewel ze de kwaliteit van het product behouden, zijn er onderzoeken die het positieve effect op het lichaam in twijfel trekken.
-Ze worden gebruikt voor de vervaardiging van kunstmatige geurstoffen die de geur en smaak van veel fruit of bloemen nabootsen. Esters zijn dus aanwezig in snoep, ijs, parfums, cosmetica, zeep, shampoos en andere commerciële producten die aantrekkelijke aroma's of smaken verdienen..
-Esters kunnen ook een positief farmacologisch effect hebben. Om deze reden heeft de farmaceutische industrie zich toegelegd op het synthetiseren van esters die zijn afgeleid van zuren die in het lichaam aanwezig zijn, om eventuele verbeteringen in de behandeling van ziekten te evalueren. Aspirine is een van de eenvoudigste voorbeelden van deze esters.
-Vloeibare esters, zoals ethylacetaat, zijn geschikte oplosmiddelen voor bepaalde soorten polymeren, zoals nitrocellulose en een breed scala aan harsen.
Voorbeelden
Enkele aanvullende voorbeelden van esters zijn als volgt:
-Pentylbutanoaat, CH3CHtweeCHtweeCOOCHtweeCHtweeCHtweeCHtweeCH3, die naar abrikoos en peren ruikt.
-Vinylacetaat, CH3COOCHtwee= CHtwee, waaruit polyvinylacetaatpolymeer wordt geproduceerd.
-Isopentylpentanoaat, CH3CHtweeCHtweeCHtweeCOOCHtweeCHtweeCH (CH3twee, die de smaak van appels nabootst.
-Ethylpropanoaat, CH3CHtweeCOOCHtweeCH3.
-Propylmethanoaat, HCOOCHtweeCHtweeCH3.
Referenties
- T.W. Graham Solomons, Craigh B. Fryhle. Organische chemie. (Tiende editie, p 797-802, 820) Wiley Plus.
- Carey, F. A. Organic Chemistry (2006) Zesde editie. Mc Graw Hill Publishing House-
- Chemie LibreTexts. Nomenclatuur van Esters. Hersteld van: chem.libretexts.org
- Beheerder. (2015, 19 september). Esters: de chemische aard, eigenschappen en toepassingen. Ontleend aan: pure-chemical.com
- Organische chemie in ons dagelijks leven. (9 maart 2014). Wat zijn de toepassingen van esters? Hersteld van: gen2chemistassignment.weebly.com
- Quimicas.net (2018). Voorbeelden van esters. Hersteld van: quimicas.net
- Paz María de Lourdes Cornejo Arteaga. Belangrijkste toepassingen van Esters. Genomen uit: uaeh.edu.mx
- Jim Clark. (Januari 2016). Introductie van Esters. Genomen uit: chemguide.co.uk



Niemand heeft nog op dit artikel gereageerd.