
Natriumsulfaat (Na2SO4) structuur, eigenschappen, gebruik, productie

De sodium sulfaat is een anorganisch zout waarvan de chemische formule Na istweeSW4. Het bestaat uit een witte vaste stof, aanwezig in drie vormen: watervrij, het heptahydraat (nauwelijks verkrijgbaar) en het decahydraat (dat bekend staat als het zout van Glaubert); dit laatste is de meest voorkomende vorm van natriumsulfaat.
Natriumsulfaatdecahydraat, NatweeSW410HtweeOf het werd in 1625 ontdekt door Glaubert in het water van een bron, die het sal mirabilis (wonderbaarlijk zout) noemde vanwege zijn geneeskrachtige eigenschappen.

Natriumsulfaat kent tal van toepassingen in de textiel- en papierindustrie, maar ook bij de fabricage van glas. Het gebruik ervan wordt uitgebreid tot thermische toepassingen, waaronder warmtetoevoer via omgevingswarmte en laptopkoeling..
Natriumsulfaat is een verbinding met een lage toxiciteit en de schadelijke effecten ervan zijn voornamelijk mechanisch en niet-chemisch. Om kristallografische redenen is dit zout, net als zijn kalium-tegenhanger, KtweeSW4, kenmerken rooster- en polymorfe structuren.
Artikel index
- 1 Structuur
- 1.1 Watervrij zout
- 1.2 Gedecahydrateerd zout
- 2 Eigenschappen
- 2.1 Namen
- 2.2 Molaire massa
- 2.3 Fysiek uiterlijk
- 2.4 Geur
- 2.5 Smaak
- 2.6 Dichtheid
- 2.7 Smeltpunt
- 2.8 Kookpunt
- 2.9 Oplosbaarheid in water
- 2.10 Brekingsindex
- 2.11 Stabiliteit
- 2.12 Ontleding
- 2,13 pH
- 2.14 Reactiviteit
- 3 toepassingen
- 3.1 Papierindustrie
- 3.2 Wasmiddelen
- 3.3 Bril
- 3.4 Textielindustrie
- 3.5 Geneeskunde
- 3.6 Droogmiddel
- 3.7 Grondstof
- 4 Verkrijgen
- 4.1 Mijnbouwwinning
- 4.2 Chemische productie
- 5 Risico's
- 6 referenties
Structuur
Watervrij zout
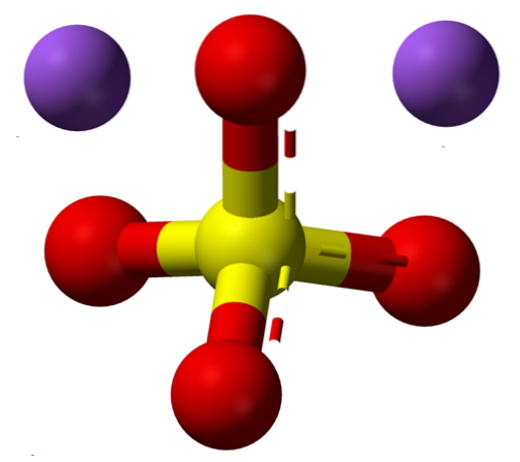
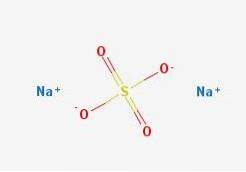
De formule NatweeSW4 geeft meteen aan dat de Na-ionen in de zoutkristallen zitten+ En dus4twee- ze hebben een verhouding van 1: 2; dat wil zeggen, voor elke twee Na kationen+ er is een anion SO4twee- interactie met hen door middel van elektrostatische aantrekking (bovenste afbeelding).
Dit geldt natuurlijk voor de NatweeSW4 watervrij, geen watermoleculen gecoördineerd met natrium in de kristallen.
Ondanks dat het een ogenschijnlijk eenvoudig zout is, is de beschrijving ervan structureel complex. Dan eentweeSW4 vertoont polymorfisme, met maximaal vijf kristallijne fasen: I, II, III, IV en V, waarvan de overgangstemperaturen respectievelijk 180, 200, 228, 235 en 883 ºC zijn.
Hoewel er geen referenties zijn om het te certificeren, is de NatweeSW4Ik moet degene zijn met een hexagonale kristallijne structuur, dichter vergeleken met het orthorhombische NatweeSW4III, in wiens kristallen Na+ vormen tetraëders (NaO4) en octaëders (NaO6) coördinatie; dat wil zeggen, het kan omgeven zijn door vier of zes anionen SO4twee-.
Gedecahydrateerd zout
Ondertussen is de monokliene kristalstructuur van zijn belangrijkste hydraat, NatweeSW410HtweeOf het is eenvoudiger. Daarin zijn het praktisch de watermoleculen die interageren of coördineren met Na+ in de octaëder Na (HtweeOF)6+, met de SO4twee- alleen voldoende stabiliteit aan het kristal verschaffen zodat het in de vaste fase bestaat.
Het smeltpunt (32,38 ºC) veel lager dan dat van het watervrije zout (884 ºC) laat echter zien hoe watermoleculen en hun waterstofbruggen de sterkere ionische interacties in Na verzwakken.tweeSW4.
Eigendommen
Namen
-Natriumsulfaat (IUPAC)
-Glauber's zout (decahydraat)
-Wonderbaarlijk zout (decahydraat)
-Dinatriumsulfaat.
Molaire massa
142,04 g / mol (watervrij)
322,20 g / mol (decahydraat)
Fysiek uiterlijk
Witte hygroscopische kristallijne vaste stof
Geur
Toilet
Smaak
Bitter en zout
Dichtheid
2.664 g / cm3 (watervrij)
1,464 g / cm3 (decahydraat)
Merk op hoe de watermoleculen in de kristallen ervoor zorgen dat ze uitzetten en daarom hun dichtheid verminderen..
Smeltpunt
884 ºC (watervrij)
32,38 ºC (decahydraat)
Kookpunt
1.429 ºC (watervrij)
Oplosbaarheid in water
4,76 g / 100 ml (0 ºC)
13,9 g / 100 ml (20 ° C)
42,7 g / 100 ml (100 ° C)
Alle oplosbaarheidswaarden komen overeen met het watervrije zout, dat bij alle temperaturen goed oplosbaar is in water..
De oplosbaarheid neemt abrupt toe tussen 0 ° C en 38,34 ° C, waarbij wordt opgemerkt dat in dit temperatuurbereik de oplosbaarheid meer dan 10 keer toeneemt. Vanaf 32,38 ºC is de oplosbaarheid echter temperatuuronafhankelijk..
Het komt voor dat bij een temperatuur van 32,8 ºC het natriumsulfaatdecahydraat oplost in zijn eigen kristallijne water. Aldus wordt een evenwicht bereikt tussen het decahydraatzout, het watervrije zout en de verzadigde oplossing van natriumsulfaat..
Zolang de driefasige toestand wordt gehandhaafd, blijft de temperatuur constant, waardoor de temperatuur van de thermometers kan worden gekalibreerd.
Aan de andere kant zijn de oplosbaarheden voor het heptahydraatzout:
19,5 g / 100 ml (0 ºC)
44,0 g / 100 ml (20 ° C)
Merk op dat het heptahydraatzout bij 20 ° C drie keer beter oplosbaar is dan het watervrije zout..
Brekingsindex
1468 (watervrij)
1.394 (decahydraat)
Stabiliteit
Stabiel onder de aanbevolen opslagomstandigheden. Onverenigbaar met sterke zuren en basen, aluminium en magnesium.
Ontleding
Bij verhitting tot ontbinding geeft het een giftige rook van zwavelig oxide en natriumoxide af..
pH
Een 5% waterige oplossing heeft een pH van 7.
Reactiviteit
Natriumsulfaat dissocieert in waterige oplossing in 2 Na+ En dus4twee-, waardoor het sulfaation kan combineren met de Batwee+ om bariumsulfaat neer te slaan. Helpt praktisch bij het verdringen van bariumionen uit watermonsters.
Natriumsulfaat wordt omgezet in natriumsulfide door bij verhoogde temperaturen te reageren met steenkool:
NatweeSW4 + 2 C => NatweeS + 2 COtwee
Glaubert's zout, NaSO4.10HtweeOf reageert met kaliumcarbonaat om natriumcarbonaat te produceren.
Toepassingen
Papierindustrie
Natriumsulfaat wordt gebruikt bij de vervaardiging van papierpulp. Het wordt gebruikt bij de productie van kraftpapier, dat geen lignine bevat of wordt onderworpen aan het bleekproces, waardoor het een grote weerstand heeft. Bovendien wordt het gebruikt bij de vervaardiging van karton.
Wasmiddelen
Gebruikt als vulmateriaal voor synthetische huishoudelijke wasmiddelen, toegevoegd aan wasmiddel om de oppervlaktespanning te verminderen.
Bril
Het wordt gebruikt bij het maken van glas om de aanwezigheid van kleine luchtbellen in gesmolten glas te verminderen of te elimineren. Bovendien elimineert het de vorming van slak tijdens het raffinageproces van het gesmolten glas.
Textielindustrie
Natriumsulfaat wordt gebruikt als bijtmiddel, omdat het de interactie van kleurstoffen met de vezels van weefsels vergemakkelijkt. Natriumsulfaatdecahydraat wordt gebruikt in de kleurtest.
Bovendien wordt natriumsulfaat gebruikt als kleurstofverdunningsmiddel en kleurstofprinthulpmiddel; zoals directe kleurstoffen, zwavelkleurstoffen en andere middelen die vlekken op katoen bevorderen. Het wordt ook gebruikt als vertragingsmiddel voor directe zijdekleurstoffen.
Geneesmiddel
Natriumsulfaatdecahydraat wordt gebruikt als laxeermiddel, omdat het slecht wordt opgenomen in de darm, en daardoor in het lumen van de darm blijft, waardoor het volume toeneemt. Dit stimuleert de toename van peristaltische contracties die de uitdrijving van de darminhoud induceren..
Natriumsulfaat is een tegengif om barium- en loodzoutvergiftiging onder controle te houden. Glaubert's zout is effectief voor het elimineren van bepaalde overmatig ingenomen medicijnen; bijvoorbeeld paracetamol (acetoaminophen).
Bovendien wordt het gebruikt om deficiënte elektrolyten in iso-osmotische oplossingen te leveren..
Droogmiddel
Natriumsulfaat, dat een inert reagens is, wordt gebruikt om water uit oplossingen van organische verbindingen te verwijderen..
Grondstof
Natriumsulfaat wordt gebruikt als grondstof voor de productie van tal van stoffen, waaronder: natriumsulfide, natriumcarbonaat en ammoniumsulfaat.
Het verkrijgen van
Natriumsulfaat wordt verkregen door mijnextractie en door chemische reacties.
Mijnbouwwinning
Er zijn drie ertsen of mineralen die worden geëxploiteerd met commerciële opbrengst: thenardiet (NatweeSW4), de mirabiliet (NatweeSW410HtweeO) en glaubariet (NatweeSW4·Geval4.
In Spanje worden de afzettingen van thenardiet en mirabiliet geëxploiteerd door ondergrondse mijnbouw van galerijen en pilaren. Ondertussen wordt het glauberiet in de open lucht verkregen door middel van grote vlotten die op de minerale afzetting worden geplaatst.
Het land wordt voorbereid met stralen met lage intensiteit om een porositeit te produceren die de uitspoeling van natriumsulfaat mogelijk maakt. De productiefase vindt plaats met de sproeierirrigatie met zoet water van het glauberiet, waarvan de uitloging zich naar beneden verspreidt..
De natriumsulfaatpekel wordt opgevangen, waarbij het calciumsulfaatresidu achterblijft als vulling..
Chemische productie
Natriumsulfaat wordt verkregen tijdens de productie van zoutzuur door twee processen: het Mannheim-proces en het Hardgreaves-proces.
Mannheim-proces
Het wordt uitgevoerd in grote staalovens en met een stalen reactieplatform van 6 m. De reactie vindt plaats tussen natriumchloride en zwavelzuur:
2 NaCl + HtweeSW4 => 2 HCl + NatweeSW4
Hardgreaves-proces
Het omvat de reactie van natriumchloride, zwaveloxide, zuurstof en water:
4 NaCl + 2 SOtwee + OFtwee + 2 uurtweeO => 4 HCl + NatweeSW4
Anderen
Natriumsulfaat wordt geproduceerd in de neutralisatiereactie tussen natriumhydroxide en zwavelzuur:
2 NaOH + HtweeSW4 => NatweeSW4 + H.tweeOF
Natriumsulfaat is een bijproduct van de productie van talrijke verbindingen. Het wordt gewonnen uit het vloeibare afval dat vrijkomt bij de productie van viscose en cellofaan. Ook bij de productie van natriumdichromaat, fenolen, boorzuur en lithiumcarbamaat.
Risico's
Natriumsulfaat wordt beschouwd als een verbinding met een lage toxiciteit. Het kan echter enige schade toebrengen aan de persoon die het onjuist gebruikt..
Het kan bijvoorbeeld oogirritatie, roodheid en pijn bij contact veroorzaken. Op de huid kan het bij sommige mensen irritatie en allergie veroorzaken. De inname ervan kan irritatie van het spijsverteringskanaal met misselijkheid, braken en diarree veroorzaken. En ten slotte veroorzaakt de inademing irritatie van de luchtwegen.
Referenties
- Shiver & Atkins. (2008). Anorganische scheikunde. (Vierde druk). Mc Graw Hill.
- Wikipedia. (2019). Sodium sulfaat. Hersteld van: en.wikipedia.org
- Nationaal centrum voor informatie over biotechnologie. (2019). Sodium sulfaat. PubChem-database. CID = 24436. Hersteld van: pubchem.ncbi.nlm.nih.gov
- B. N. Mehrotra. (1978). De kristalstructuur van NatweeSW4III. Hersteld van: rruff-2.geo.arizona.edu
- Glauberiet-Thenardiet (natriumsulfaat). [Pdf]. Hersteld van: igme.es



Niemand heeft nog op dit artikel gereageerd.