
Periodiek systeem der elementen geschiedenis, structuur, elementen

De periodiek systeem der elementen is een tool waarmee je de chemische eigenschappen van de 118 tot nu toe bekende elementen kunt raadplegen. Het is essentieel bij het uitvoeren van stoichiometrische berekeningen, het voorspellen van de fysische eigenschappen van een element, het classificeren ervan en het vinden van periodieke eigenschappen tussen alle..
Atomen worden zwaarder naarmate hun kernen protonen en neutronen toevoegen, die ook vergezeld moeten gaan van nieuwe elektronen; anders zou elektroneutraliteit niet mogelijk zijn. Sommige atomen zijn dus erg licht, zoals waterstof, en andere superzwaar, zoals oganeson.
Aan wie is zo'n hart in de scheikunde te danken? Aan de wetenschapper Dmitri Mendeleev, die in 1869 (bijna 150 jaar geleden), na een decennium van theoretische studies en experimenten, het eerste periodiek systeem publiceerde in een poging om de 62 toen bekende elementen te ordenen.
Hiervoor vertrouwde Mendelejev op chemische eigenschappen, terwijl Lothar Meyer tegelijkertijd een ander periodiek systeem publiceerde dat was georganiseerd volgens de fysieke eigenschappen van de elementen..
Aanvankelijk bevatte de tafel "lege ruimtes", waarvan de elementen in die jaren niet bekend waren. Mendelejev was echter in staat om verschillende van zijn eigenschappen met aanzienlijke nauwkeurigheid te voorspellen. Enkele van deze elementen waren: germanium (dat hij eka-silicium noemde) en gallium (eka-aluminium).
De eerste periodieke tafels rangschikten de elementen op basis van hun atoommassa. Deze ordening onthulde enige periodiciteit (herhaling en gelijkenis) in de chemische eigenschappen van de elementen; de overgangselementen waren het echter niet eens met dit bevel, net als de edelgassen.
Om deze reden was het nodig om de elementen te ordenen rekening houdend met het atoomnummer (aantal protonen), in plaats van de atoommassa. Vanaf hier, samen met het harde werk en de bijdragen van vele auteurs, werd het periodiek systeem van Mendelejev verfijnd en voltooid..
Artikel index
- 1 Geschiedenis van het periodiek systeem
- 1.1 Elementen
- 1.2 Symboliek
- 1.3 Evolutie van de regeling
- 1.4 Tellurische schroef van Chancourtois (1862)
- 1.5 octaven van Newlands (1865)
- 1.6 Mendeleev's Table (1869)
- 1.7 Moseley's periodiek systeem (huidig periodiek systeem) - 1913
- 2 Hoe is het georganiseerd? (Structuur en organisatie)
- 2.1 Termijnen
- 2.2 Groepen
- 2.3 Aantallen protonen versus valentie-elektronen
- 3 Elementen van het periodiek systeem
- 3.1 Blokken
- 3,2 p blok
- 3.3 Representatieve elementen
- 3.4 Overgangsmetalen
- 3.5 Interne overgangsmetalen
- 3.6 Metalen en niet-metalen
- 3.7 Metaalfamilies
- 3.8 Metalloïden
- 3.9 Gassen
- 4 Gebruik en toepassingen
- 4.1 Voorspelling van oxideformules
- 4.2 Valenties van de elementen
- 4.3 Digitale periodieke tafels
- 5 Belang van het periodiek systeem
- 6 referenties
Geschiedenis van het periodiek systeem
Elementen
Het gebruik van elementen als basis om de omgeving (meer precies, de natuur) te beschrijven, wordt al sinds de oudheid gebruikt. In die tijd werden ze echter de fasen en toestanden van de materie genoemd, en niet op de manier waarop er vanaf de middeleeuwen naar wordt verwezen..
De oude Grieken geloofden dat de planeet die we bewonen bestond uit de vier fundamentele elementen: vuur, aarde, water en lucht..
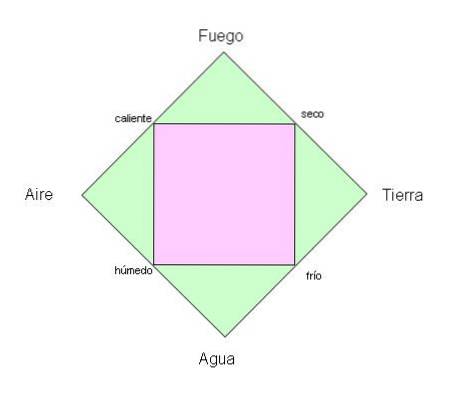
Aan de andere kant was het aantal elementen in het oude China vijf en, in tegenstelling tot de Grieken, sloten deze lucht uit en omvatten ze metaal en hout..

De eerste wetenschappelijke ontdekking werd gedaan in 1669 door de Duitse Henning Brand, die fosfor ontdekte; vanaf die datum werden alle volgende items geregistreerd.

Het is de moeite waard om te verduidelijken dat sommige elementen zoals goud en koper al bekend waren vóór fosfor; het verschil is dat ze nooit zijn geregistreerd.
Symboliek
De alchemisten (voorouders van de huidige scheikundigen) gaven namen aan de elementen in relatie tot de sterrenbeelden, hun ontdekkers en de plaatsen waar ze werden ontdekt.
In 1808 stelde Dalton een reeks tekeningen (symbolen) voor om de elementen weer te geven. Later werd dit notatiesysteem vervangen door dat van Jhon Berzelius (tot nu toe gebruikt), aangezien het model van Dalton ingewikkelder werd naarmate er nieuwe elementen verschenen..
Schema evolutie
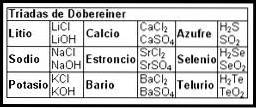
De eerste pogingen om een kaart te maken die de informatie van de chemische elementen organiseerde, vonden plaats in de 19e eeuw met de Döbereiner Triads (1817).
In de loop der jaren zijn er nieuwe elementen gevonden, die aanleiding hebben gegeven tot nieuwe organisatiemodellen tot aan het huidige..
Chancourtois Telluric Screw (1862)
Alexandré-Émile Béguyer de Chancourtois ontwierp een papieren helix met een grafiek van spiralen (tellurische schroef).
In dit systeem zijn de elementen gerangschikt in oplopende volgorde met betrekking tot hun atoomgewichten. Vergelijkbare items zijn verticaal uitgelijnd.
Octaven van Newlands (1865)
Voortbordurend op het werk van Döbereiner, rangschikte de Britse John Alexander Reina Newlands de chemische elementen in oplopende volgorde met betrekking tot atoomgewichten, waarbij hij opmerkte dat elke zeven elementen overeenkomsten vertoonden in hun eigenschappen (waterstof is niet inbegrepen).
Mendeleev's Table (1869)
Mendelejev rangschikte de chemische elementen in oplopende volgorde met betrekking tot het atoomgewicht en plaatste in dezelfde kolom die waarvan de eigenschappen vergelijkbaar waren. Hij liet hiaten achter in zijn periodiek systeemmodel vooruitlopend op het verschijnen van nieuwe elementen in de toekomst (naast het voorspellen van de eigenschappen die het zou moeten hebben).
Edelgassen komen niet voor in de tafel van Mendelejev, omdat ze nog niet waren ontdekt. Bovendien hield Mendeleiv geen rekening met waterstof.
Moseley's periodiek systeem (huidig periodiek systeem) - 1913
Henry Gwyn Jeffreys Moseley stelde voor om de chemische elementen van het periodiek systeem te ordenen op basis van hun atoomnummer; dat wil zeggen, als functie van het aantal protonen.
Moseley formuleerde de "Periodieke Wet" in 1913: "Wanneer elementen gerangschikt zijn in volgorde van hun atoomnummer, vertonen hun fysische en chemische eigenschappen periodieke trends".
Elke horizontale rij of periode toont dus een type relatie, en elke kolom of groep toont een andere..
Hoe is het georganiseerd? (Structuur en organisatie)
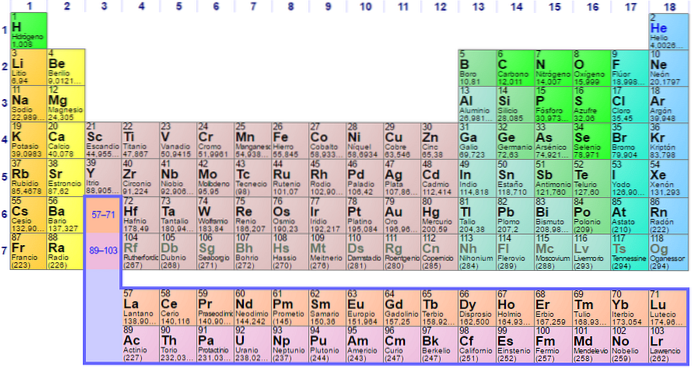
Het is te zien dat de pastel van het periodiek systeem verschillende kleuren heeft. Elke kleur associeert elementen met vergelijkbare chemische eigenschappen. Er zijn oranje, gele, blauwe, paarse kolommen; groene vierkanten en een appelgroene diagonaal.
Merk op dat de cellen in de middelste kolommen grijsachtig van kleur zijn, dus al deze elementen moeten iets gemeen hebben, namelijk dat het overgangsmetalen zijn met halfvolle d-orbitalen..
Op dezelfde manier zijn de elementen van de paarse vierkanten, hoewel ze gaan van gasvormige stoffen, van een roodachtige vloeistof tot vast zwart-paars (jodium) en zilvergrijs (astatine), het zijn hun chemische eigenschappen die ze soortgenoten maken. Deze eigenschappen worden bepaald door de elektronische structuren van zijn atomen..
De organisatie en structuur van het periodiek systeem is niet willekeurig, maar volgt een reeks periodieke eigenschappen en waardenpatronen die voor de elementen zijn bepaald. Als het metalen karakter bijvoorbeeld van links naar rechts van de tafel afneemt, kan een metalen element in de rechterbovenhoek niet worden verwacht.
Perioden
De elementen zijn gerangschikt in rijen of perioden, afhankelijk van het energieniveau van hun orbitalen. Vóór periode 4, toen de elementen elkaar opvolgden in oplopende volgorde van atomaire massa, bleek dat voor elke acht ervan de chemische eigenschappen zich opnieuw herhaalden (de wet van octaven van John Newlands).
De overgangsmetalen werden gegoten met andere niet-metalen elementen, zoals zwavel en fosfor. Om deze reden was de intrede van kwantumfysica en elektronenconfiguraties van vitaal belang voor het begrip van moderne periodieke tafels..
De orbitalen van een energieschil vullen zich met elektronen (en de kernen van protonen en neutronen) terwijl deze door een periode beweegt. Deze energielaag gaat hand in hand met de grootte of atoomstraal; daarom zijn de elementen van de bovenste perioden kleiner dan die eronder.
H en He bevinden zich in het eerste (periodieke) energieniveau; de eerste rij grijsachtige vierkanten, in de vierde periode; en de rij oranje vierkantjes, in de zesde periode. Merk op dat, hoewel de laatste zich in de veronderstelde negende periode lijkt te bevinden, hij eigenlijk tot de zesde behoort, net na het gele vak van Ba.
Groepen
Als we een periode doorlopen, blijkt dat de massa, het aantal protonen en elektronen toeneemt. In dezelfde kolom of groep, hoewel de massa en protonen variëren, het aantal valentie schil elektronen is hetzelfde.
In de eerste kolom of groep heeft de H bijvoorbeeld een enkel elektron in de 1s-orbitaal1, zoals de Li (2s1), natrium (3s1), kalium (4s1) enzovoort tot francium (7s1Dat getal 1 geeft aan dat deze elementen nauwelijks een valentie-elektron hebben en daarom tot groep 1 (IA) behoren. Elk element bevindt zich in verschillende periodes.
De groene omkadering van waterstof niet meegerekend, de elementen eronder zijn oranje omkaderd en worden alkalimetalen genoemd. Nog een vakje naar rechts in een willekeurige periode, is de groep of kolom 2; dat wil zeggen, zijn elementen hebben twee valentie-elektronen.
Maar als je een stap verder naar rechts gaat, zonder medeweten van de d-orbitalen, kom je uit bij de boorgroep (B) of groep 13 (IIIA); in plaats van groep 3 (IIIB) of scandium (Sc). Rekening houdend met de vulling van de d-orbitalen, begint men de perioden van de grijsachtige vierkanten te doorlopen: de overgangsmetalen.
Aantallen protonen versus valentie-elektronen
Bij het bestuderen van het periodiek systeem kan er verwarring ontstaan tussen het atoomnummer Z of het totale aantal protonen in de kern, en het aantal valentie-elektronen. Koolstof heeft bijvoorbeeld een Z = 6, dat wil zeggen, het heeft zes protonen en daarom zes elektronen (anders zou het geen neutraal geladen atoom kunnen zijn).
Maar van die zes elektronen, vier komen uit valencia. Om die reden is zijn elektronenconfiguratie [He] 2stwee2 Blztwee. [He] duidt de twee 1s-elektronen aantwee van de gesloten laag, en nemen theoretisch niet deel aan de vorming van chemische bindingen.
Omdat koolstof vier valentie-elektronen heeft, bevindt het zich bovendien "handig" in groep 14 (IVA) van het periodiek systeem..
De elementen onder koolstof (Si, Ge, Sn, Pb en Fl) hebben hogere atoomnummers (en atoommassa's); maar ze hebben allemaal de vier valentie-elektronen gemeen. Dit is de sleutel om te begrijpen waarom een element tot de ene groep behoort en niet tot een andere..
Elementen van het periodiek systeem
Blok s
Zoals zojuist uitgelegd, worden groepen 1 en 2 gekenmerkt door een of twee elektronen in s orbitalen. Deze orbitalen hebben een sferische geometrie, en als men door een van deze groepen afdaalt, krijgen de elementen lagen die de grootte van hun atomen vergroten..
Omdat ze sterke tendensen vertonen in hun chemische eigenschappen en reactiemethoden, zijn deze elementen georganiseerd als het s-blok. Daarom behoren de alkalimetalen en de aardalkalimetalen tot dit blok. De elektronenconfiguratie van de elementen van dit blok is ns (1s, 2s, etc.).
Hoewel het element helium zich in de rechterbovenhoek van de tafel bevindt, is de elektronenconfiguratie 1stwee en behoort daarom tot dit blok.
Blokkeren p
In tegenstelling tot het s-blok, hebben de elementen van dit blok s orbitalen volledig gevuld, terwijl hun p-orbitalen gevuld blijven met elektronen. De elektronische configuraties van de elementen die bij dit blok horen, zijn van het type nstweenp1-6 (p orbitalen kunnen een of maximaal zes elektronen hebben om te vullen).
Dus waar op het periodiek systeem bevindt dit blok zich? Aan de rechterkant: de groene, paarse en blauwe vierkanten; d.w.z. niet-metalen elementen en zware metalen, zoals bismut (Bi) en lood (Pb).
Beginnend met boor, met elektronenconfiguratie nstweenp1, de koolstof rechts voegt nog een elektron toe: 2stwee2 Blztwee. Vervolgens zijn de elektronenconfiguraties van de andere elementen van periode 2 van blok p: 2stwee2 Blz3 (stikstof), 2 sectwee2 Blz4 (zuurstof), 2stwee2 Blz5 (fluor) en 2stwee2 Blz6 (neon).
Als je naar de lagere periodes gaat, heb je het energieniveau 3: 3stwee3p1-6, enzovoort tot het einde van blok p.
Merk op dat het belangrijkste van dit blok is dat, vanaf periode 4, de elementen volledig gevuld zijn met d orbitalen (blauwe vakken aan de rechterkant). Kort gezegd: blok s staat aan de linkerkant van het periodiek systeem en blok p aan de rechterkant.
Representatieve elementen
Wat zijn de representatieve elementen? Het zijn degenen die enerzijds gemakkelijk elektronen verliezen, of anderzijds ze winnen om het octet van valentie te voltooien. Met andere woorden: het zijn de elementen van de blokken s en p.
Hun groepen werden aan het einde van de anderen onderscheiden door een letter A. Er waren dus acht groepen: van IA tot VIIIA. Maar momenteel is het nummeringssysteem dat in moderne periodieke tafels wordt gebruikt Arabisch, van 1 tot 18, inclusief de overgangsmetalen..
Om die reden kan de boorgroep IIIA of 13 (3 + 10) zijn; de koolstofgroep, BTW of 14; en dat van edelgassen, de laatste aan de rechterkant van de tafel, VIIIA of 18.
Overgangsmetalen
De overgangsmetalen zijn alle elementen van de grijsachtige vierkanten. Gedurende hun perioden zijn hun d-orbitalen gevuld, die vijf zijn en daarom tien elektronen kunnen hebben. Omdat ze tien elektronen moeten hebben om deze orbitalen te vullen, moeten er tien groepen of kolommen zijn.
Elk van deze groepen in het oude nummeringssysteem werd aangeduid met Romeinse cijfers en een letter B aan het einde. De eerste groep, die van scandium, was IIIB (3), die van ijzer, kobalt en nikkel VIIIB met zeer vergelijkbare reactiviteiten (8, 9 en 10), en die van zink IIB (12).
Zoals te zien is, is het veel gemakkelijker om groepen te herkennen aan Arabische cijfers dan aan Romeinse cijfers..
Interne overgangsmetalen
Vanaf periode 6 van het periodiek systeem komen de f orbitalen energetisch beschikbaar. Deze moeten eerst worden gevuld dan de d orbitalen; en daarom worden de elementen meestal uit elkaar geplaatst om de tafel niet te veel te verlengen.
De laatste twee periodes, oranje en grijs, zijn de interne overgangsmetalen, ook wel lanthaniden (zeldzame aarden) en actiniden genoemd. Er zijn zeven f-orbitalen, die veertien elektronen nodig hebben om te vullen, en daarom moeten er veertien groepen zijn.
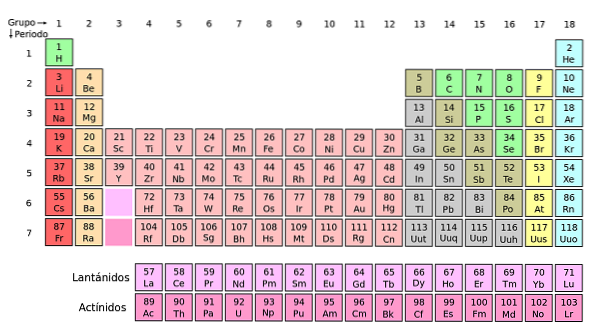
Als deze groepen worden toegevoegd aan het periodiek systeem, zijn er in totaal 32 (18 + 14) en komt er een "lange" versie:
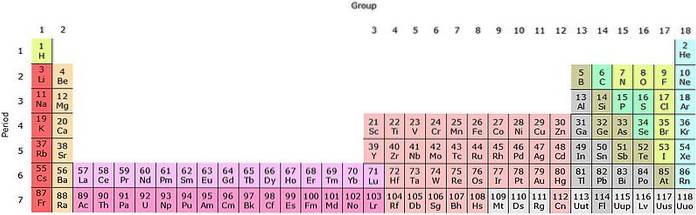
De lichtroze rij komt overeen met de lanthanoïden, terwijl de donkerroze rij overeenkomt met de actinoïden. Lanthaan, La met Z = 57, actinium, Ac met Z = 89, en het hele f-blok behoren tot dezelfde groep als scandium. Waarom? Omdat scandium een orbitaal heeft1, die aanwezig is in de rest van de lanthanoïden en actinoïden.
La en Ac hebben 5d-valentie-instellingen16stwee en 6d17stwee. Terwijl je door beide rijen naar rechts beweegt, beginnen de 4f- en 5f-orbitalen zich te vullen. Eenmaal gevuld, krijg je de elementen lutetium, Lu en laurencio, Lr.
Metalen en niet-metalen
Als je de taart van het periodiek systeem achterlaat, is het handiger om je toevlucht te nemen tot die in de bovenste afbeelding, zelfs in zijn langwerpige vorm. Op dit moment zijn de overgrote meerderheid van de genoemde elementen metalen.
Bij kamertemperatuur zijn alle metalen vaste stoffen (behalve kwik, dat vloeibaar is) met een zilvergrijze kleur (behalve koper en goud). Ze hebben ook de neiging hard en glanzend te zijn; hoewel die van blokken zacht en broos zijn. Deze elementen worden gekenmerkt door het gemak waarmee ze elektronen verliezen en kationen M vormen+.
In het geval van lanthanoïden verliezen ze alle drie de 5d-elektronen16stwee driewaardige kationen worden M3+ (zoals zij3+Cerium van zijn kant kan vier elektronen verliezen (Ce4+.
Aan de andere kant vormen niet-metalen elementen het minste deel van het periodiek systeem. Het zijn gassen of vaste stoffen met covalent gebonden atomen (zoals zwavel en fosfor). Ze bevinden zich allemaal in blok p; meer precies, in het bovenste deel ervan, omdat het afdalen naar de lagere perioden het metaalachtige karakter verhoogt (Bi, Pb, Po).
Ook niet-metalen in plaats van elektronen te verliezen, krijg je ze. Ze vormen dus anionen X- met verschillende negatieve ladingen: -1 voor halogenen (groep 17), en -2 voor chalcogenen (groep 16, zuurstof).
Metallic families
Binnen metalen is er een interne classificatie om ze van elkaar te onderscheiden:
-Metalen van groep 1 zijn alkalisch
-Groep 2, aardalkalimetalen (Mr.Becambara)
-Groep 3 (IIIB) scandiumfamilie. Deze familie bestaat uit scandium, hoofd van de groep, yttrium Y, lanthaan, actinium en alle lanthanoïden en actinoïden.
-Groep 4 (IVB), titaniumfamilie: Ti, Zr (zirkonium), Hf (hafnium) en Rf (rutherfordium). Hoeveel valentie-elektronen hebben ze? Het antwoord ligt in uw groep.
-Groep 5 (VB), vanadiumfamilie. Groep 6 (VIB), chroomfamilie. En zo verder tot aan de zinkfamilie, groep 12 (IIB).
Metalloïden
Het metaalachtige karakter neemt toe van rechts naar links en van boven naar beneden. Maar wat is de grens tussen deze twee soorten chemische elementen? Deze rand is samengesteld uit elementen die bekend staan als metalloïden, die kenmerken hebben van zowel metalen als niet-metalen..
Metalloïden zijn te zien op het periodiek systeem in de "ladder" die begint met boor en eindigt met het radioactieve element astatine. Deze elementen zijn:
-B: boor
-Silicium: ja
-Ge: germanium
-Zoals: arseen
-Sb: antimoon
-Te: tellurium
-Op: astatine
Elk van deze zeven elementen vertoont tussenliggende eigenschappen, die variëren afhankelijk van de chemische omgeving of temperatuur. Een van deze eigenschappen is halfgeleiding, dat wil zeggen dat metalloïden halfgeleiders zijn.
Gassen
Onder aardse omstandigheden zijn de gasvormige elementen die niet-lichte metalen, zoals stikstof, zuurstof en fluor. Ook chloor, waterstof en edelgassen vallen onder deze classificatie. Van allemaal zijn de edelgassen de meest karakteristieke, vanwege hun geringe neiging om te reageren en zich als vrije atomen te gedragen..
De laatste zijn te vinden in groep 18 van het periodiek systeem en zijn:
-Helium, He
-Neon, Ne
-Argon, Ar
-krypton, Kr
-Xenon, Xe
-Radon, Rn
-En de meest recente van allemaal, de synthetische edelgas oganeson, Og.
Alle edelgassen hebben de valentieconfiguratie ns gemeentweenp6dat wil zeggen, ze hebben het volledige valentie-octet.
Toestanden van aggregatie van elementen bij andere temperaturen
De elementen bevinden zich in vaste, vloeibare of gasvormige toestand, afhankelijk van de temperatuur en de sterkte van hun interacties. Als de temperatuur van de aarde afkoelde tot rond het absolute nulpunt (0K), zouden alle elementen bevriezen; behalve helium, dat zou condenseren.
Bij deze extreme temperatuur zou de rest van de gassen in de vorm van ijs zijn.
Aan het andere uiterste, als de temperatuur ongeveer 6000 K was, zouden "alle" elementen in gasvormige toestand zijn. Onder deze omstandigheden kon je letterlijk wolken van goud, zilver, lood en andere metalen zien.
Toepassingen en toepassingen
Het periodiek systeem zelf is altijd een hulpmiddel geweest en zal het zijn om de symbolen, atoommassa's, structuren en andere eigenschappen van de elementen te raadplegen. Het is uitermate handig bij het uitvoeren van stoichiometrische berekeningen, die aan de orde van de dag zijn bij veel taken binnen en buiten het laboratorium.
Niet alleen dat, maar ook met het periodiek systeem kunt u de elementen van dezelfde groep of periode vergelijken. Zo kan men voorspellen hoe bepaalde verbindingen van de elementen eruit zullen zien.
Voorspelling van oxideformules
Bijvoorbeeld, voor alkalimetaaloxiden, omdat ze een enkel valentie-elektron hebben, en dus een valentie van +1, wordt verwacht dat de formule van hun oxiden van het M-type istweeO. Dit wordt gecontroleerd met waterstofoxide, water, HtweeO. Ook met natriumoxiden, NatweeO, en kalium, KtweeOF.
Voor de andere groepen moeten hun oxiden de algemene formule M hebbentweeOFn, waarbij n gelijk is aan het groepsnummer (als het element uit blok p komt, wordt n-10 berekend). Zo vormt koolstof, dat tot groep 14 behoort, COtwee (C.tweeOF4/twee); zwavel, uit groep 16, SO3 (S.tweeOF6/twee); en stikstof, groep 15, NtweeOF5.
Dit geldt echter niet voor overgangsmetalen. Dit komt omdat ijzer, hoewel het tot groep 8 behoort, geen 8 elektronen kan verliezen, maar 2 of 3. Daarom is het belangrijker om te letten op de valenties van elk element in plaats van de formules te onthouden..
Valenties van de elementen
De periodieke tabellen (sommige) tonen de mogelijke valenties voor elk element. Als u deze kent, kan de nomenclatuur van een verbinding en de chemische formule van tevoren worden geschat. Valenties, zoals eerder vermeld, zijn gerelateerd aan het groepsnummer; hoewel het niet op alle groepen van toepassing is.
De valenties zijn meer afhankelijk van de elektronische structuur van de atomen, en welke elektronen ze daadwerkelijk kunnen verliezen of winnen..
Door het aantal valentie-elektronen te kennen, kun je op basis van deze informatie ook beginnen met de Lewis-structuur van een verbinding. Het periodiek systeem stelt studenten en professionals daarom in staat om structuren te schetsen en plaats te maken voor het onderzoeken van mogelijke geometrieën en moleculaire structuren..
Digitale periodieke tafels
Tegenwoordig heeft de technologie het mogelijk gemaakt dat periodieke tabellen veelzijdiger zijn en meer informatie voor iedereen beschikbaar is. Verscheidene daarvan brengen opvallende illustraties van elk element, evenals een korte samenvatting van de belangrijkste toepassingen.
De manier waarop u met hen omgaat, versnelt uw begrip en studie. Het periodiek systeem moet een hulpmiddel zijn dat een lust voor het oog is, gemakkelijk te onderzoeken is en de meest effectieve methode om de chemische elementen ervan te kennen, is om er van periodes naar groepen doorheen te gaan..
Belang van het periodiek systeem
Tegenwoordig is het periodiek systeem het belangrijkste ordeningsinstrument in de chemie vanwege de gedetailleerde relaties tussen de elementen. Het gebruik ervan is essentieel voor zowel studenten en docenten als voor onderzoekers en vele professionals die zich toeleggen op de tak van scheikunde en techniek..
Alleen al door naar het periodiek systeem te kijken, krijg je een enorme hoeveelheid en informatie snel en efficiënt, zoals:
- Lithium (Li), beryllium (Be) en boor (B) geleiden elektriciteit.
- Lithium is een alkalimetaal, beryllium is een aardalkalimetaal en boor is een niet-metaal.
- Lithium is de beste geleider van de drie genoemde, gevolgd door beryllium en ten slotte boor (halfgeleider).
Dus door deze elementen in het periodiek systeem te plaatsen, kan hun neiging tot elektrische geleidbaarheid onmiddellijk worden beëindigd..
Referenties
- Scerri, E. (2007). Het periodiek systeem: zijn verhaal en zijn betekenis. Oxford New York: Oxford University Press.
- Scerri, E. (2011). Het periodiek systeem: een zeer korte inleiding. Oxford New York: Oxford University Press.
- Moore, J. (2003). Chemie voor dummies. New York, NY: Wiley Pub.
- Venable, F.P… (1896). De ontwikkeling van de periodieke wet. Easton, Pennsylvania: Chemical Publishing Company.
- Ball, P. (2002). De ingrediënten: een rondleiding door de elementen. Oxford New York: Oxford University Press.
- Whitten, Davis, Peck & Stanley. Chemie. (8e ed.). CENGAGE Leren.
- Royal Society of Chemistry. (2018). Periodiek systeem. Hersteld van: rsc.org
- Richard C. Banks. (Januari 2001). Het periodiek systeem. Hersteld van: chemistry.boisestate.edu
- Fysica 2000. (s.f.). De oorsprong van het periodiek systeem. Hersteld van: physics.bk.psu.edu
- King K. & Nazarewicz W. (7 juni 2018). Komt er een einde aan het periodiek systeem? Hersteld van: msutoday.msu.edu
- Dr. Doug Stewart. (2018). Het periodiek systeem. Hersteld van: chemicool.com
- Mendez A. (16 april 2010). Mendeleev's periodiek systeem. Hersteld van: quimica.laguia2000.com



Niemand heeft nog op dit artikel gereageerd.