
Kinyoun kleuring grondgedachte en technieken

De Kinyoun vlek is een kleurtechniek die wordt gebruikt om zuurvaste bacteriën en parasieten te kleuren. Het werd geboren uit de modificatie van de Ziehl-Neelsen-kleuring; Beide technieken worden op dezelfde manier geïnterpreteerd, maar verschillen in twee elementen: bij de bereiding van het hoofdreagens en doordat de Kinyoun-techniek geen warmte gebruikt.
Om deze reden wordt het ook wel koud gemodificeerde Ziehl-Neelsen of Kinyoun koudbeits genoemd. Het is aangegeven voor het inkleuren van Mycobacterium tuberculosis, Mycobacterium leprae, atypische mycobacteriën, Nocardias sp, Cryptosporidium parvum, Cryptosporidium meleagridis, Cryptosporidium felis, Cryptosporidium muris Y Cyclosporas cayetanensis.
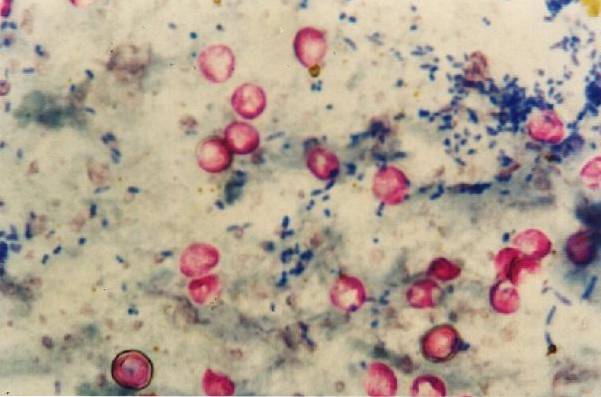
Het is vermeldenswaard dat de Nocardia zwak kleurt met deze techniek omdat ze gedeeltelijk zuur-alcoholbestendig zijn, dus voor dit geslacht is er een wijziging van de methodologie.
Op zijn beurt is de koude Kinyoun-techniek gecombineerd met de trichrome-techniek die door Didier is aangepast voor de detectie van coccidia (Cryptosporidium parvum en Isospora belli) en microsporidia-sporen (Enterocytozoon bieneusi Y Encephalitozoon intestinalis.
Artikel index
- 1 Grondgedachte
- 2 Techniek
- 2.1 Materialen
- 2.2 Bereiding van Kinyoun's carbol fuchsine
- 2.3 Bereiding van de zuur-alcohol
- 2.4 Bereiding van methyleenblauw contrastkleurstof
- 2.5 Kinyoun-kleurtechniek
- 2.6 Speciale Kinyoun-techniek voor nocardia's
- 2.7 Gecombineerde carbol fuchsin en trichrome techniek gemodificeerd door Didier
- 2.8 Kwaliteitscontrole
- 3 Kinyoun-techniek vergeleken met de Ziehl-Neelsen-techniek
- 4 Referentie
Basis
Het belangrijkste kleuringsmiddel is carbolfuchsine of carbolfuchsine, dat de eigenschap heeft zich te binden aan de carbolzuren die in de wasachtige celwand aanwezig zijn en rijk zijn aan lipiden (mycolzuren) van mycobacteriën en bepaalde parasieten..
Deze binding wordt niet tegengegaan door het zure bleekmiddel; daarom worden micro-organismen gedefinieerd als zuur-alcoholbestendig.
In tegenstelling tot de Ziehl-Neelsen-techniek -die de kleurstof door warmte fixeert-, is deze stap bij de Kinyoun-techniek niet nodig, aangezien de voor deze techniek bereide carbol-fuchsine-oplossing een hoge concentratie fenol bevat..
Fenol lost het lipidemateriaal op in de celwand, waardoor de carbolfuchsinekleurstof kan binnendringen. Nadat de kleurstof is doordrongen, blijft deze vast, ondanks wassen met de zure alcohol.
Op deze manier krijgen zuurbestendige micro-organismen de karakteristieke rode kleur, terwijl alles wat niet zuurbestendig is alcohol verkleurt en blauw wordt..
Techniek
Materialen
- Gemodificeerde carbol fuchsin.
- Alcohol-zuur.
- Methyleenblauw.
Bereiding van Kinyoun Carbol Fuchsin
- Basis fuchsine: 4 gr.
- Fenol: 8 ml.
- Alcohol (95%): 20 ml.
- Gedestilleerd water: 100 ml.
De basisfuchsine moet langzaam in de alcohol worden opgelost en constant worden gemengd. Vervolgens wordt het gekristalliseerde fenol gesmolten in een waterbad van 56 ° C. Eenmaal opgelost, wordt 8 ml toegevoegd aan de hierboven bereide fuchsine-oplossing.
Bereiding van de zuur-alcohol
- Geconcentreerd zoutzuur: 3 ml.
- Ethanol (95%): 97 ml.
Het moet worden gemeten, samengevoegd en gemengd.
Bereiding van de contrastkleurstof methyleenblauw
- Methyleenblauw: 0,3 g.
- Gedestilleerd water: 100 ml.
Het wordt gewogen en opgelost.
Kinyoun-kleurtechniek
1- Maak een uitstrijkje rechtstreeks van het monster, dat onder andere kan bestaan uit sputum, longvloeistof, urinesediment, hersenvocht of ontlasting; of uit een suspensie van micro-organismen die zijn verkregen uit zuivere kolonies die zijn ontwikkeld in primaire kweekmedia.
2- Fixeer het uitstrijkje met warmte.
3- Plaats het uitstrijkje op de kleuringsbrug en bedek het met het voorbereide Kinyoun carbol fuchsine-reagens. Laat het 3 of 5 minuten rusten.
4- Wassen met gedestilleerd water.
5- Bleekmiddel met zure alcohol gedurende 3 minuten en was opnieuw met gedestilleerd water.
6- Bleek opnieuw met zure alcohol gedurende 1 of 2 minuten totdat er geen kleur meer weggaat.
7- Was met gedestilleerd water en laat uitlekken, waarbij u de glijbaan verticaal plaatst.
8- Bedek het preparaat met methyleenblauw en laat 4 minuten inwerken.
9- Was met gedestilleerd water en laat aan de lucht drogen.
10- Onderzoek op 40X en vervolgens op 100X.
Als je de kleuring van zuurvaste micro-organismen wilt verbeteren en versnellen, voeg dan 1 druppel bevochtigingsmiddel (zoals Tergitol nr. 7) toe aan 30 of 40 ml Kinyoun Carbol Fuchsin.
Sommige laboratoria veranderen de methyleenblauwe contrastkleurstof in heldergroen of picrinezuur; de eerste geeft een groene kleur aan de achtergrond en de tweede genereert een gele kleur.
Speciale Kinyoun-techniek voor nocardia's
Om de kleuring van bacteriën van het geslacht Nocardia te verbeteren, wordt een modificatie van de Kinyoun-kleuring gebruikt. De techniek is als volgt:
1- Bedek het uitstrijkje met Kinyoun carbol fuchsin gedurende 3 minuten.
2- Wassen met gedestilleerd water.
3- Verkleur kort met zure alcohol bereid met 3% tot geen kleur meer wordt gedragen.
4- Was opnieuw met gedestilleerd water.
5- Bedek de bereiding met methyleenblauw en laat 30 seconden staan.
6- Was met gedestilleerd water en laat aan de lucht drogen.
Gecombineerde carbol fuchsin en trichrome techniek aangepast door Didier
Deze techniek wordt aanbevolen voor de analyse van ontlastingsmonsters op coccidia en sporen van Microsporidium sp tegelijkertijd. De te volgen procedure is als volgt:
1- Bedek het uitstrijkje met Kinyoun carbol fuchsin gedurende 10 minuten.
2- Verwijder de kleurstof en was met gedestilleerd water.
3- Bleek gedurende 30 seconden met zoutzuuralcohol.
4- Was opnieuw met gedestilleerd water.
5- Bedek het uitstrijkje met een trichroomoplossing gedurende 30 minuten bij 37 ° C.
6- Wassen met gedestilleerd water.
7- Bleek gedurende 10 seconden met azijnzuuralcohol.
8- Was het uitstrijkje gedurende 30 seconden met 95% ethanol.
QA
Als positieve controle worden uitstrijkjes bereid met stammen van Mycobacterium tuberculosis en beits met de voorbereide reagentia om te controleren of de bacteriën de juiste kleur aannemen (rood-fuchsia).
Negatieve controles kunnen ook worden gebruikt bij het bereiden van uitstrijkjes met een stam die niet zuurvast is, zodat wordt gecontroleerd of het hele monster de contrasterende kleur aanneemt..
Kinyoun-techniek vergeleken met de Ziehl-Neelsen-techniek
De Kinyoun-techniek is eenvoudiger omdat het de verwarmingsstap overbodig maakt, maar het belangrijkste voordeel is dat het op lange termijn de uitstoot van zeer giftige en kankerverwekkende dampen vermijdt. Daarom is de Kinyoun-kleurstof veiliger voor kleurpersoneel..
Het is belangrijk om er rekening mee te houden dat ervoor moet worden gezorgd dat de reagentia niet in direct contact komen met de huid, aangezien ze bijtend zijn en het bleekmiddel ontvlambaar is..
Wat de nadelen betreft, een negatief uitstrijkje betekent niet noodzakelijk dat het organisme niet aanwezig is. Bovendien kan de aanwezigheid van celresten leiden tot vals-positieven, wat leidt tot verwarring bij de diagnose..
Referentie
- Toegepaste klinische chemie. (2016). BK Kinyoun Kit Beschikbaar op: cromakit.es
- Orozco-Rico Miguel. Kinyoun-vlek en twee Coccidia bij HIV. Medisch tijdschrift MD. 2011; 3 (2): 137
- Forbes B, Sahm D, Weissfeld A (2009). Bailey & Scott Microbiologische diagnose. 12 ed. Argentinië. Redactioneel Panamericana S.A.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. (5e ed.). Argentinië, Redactie Panamericana S.A.
- Wikipedia-bijdragers. "Kinyoun-vlek." Wikipedia, de gratis encyclopedie. Wikipedia, The Free Encyclopedia, 8 februari 2018. Web. 5 januari 2019.
- Combol A, Fernández N, Figueredo E, Acuña A, Zanetta E. Implementatie van een kleurtechniek voor de gelijktijdige diagnose van Coccidia en Microsporidia. Instituut voor Hygiëne van de Universiteit van de Republiek. Montevideo. Uruguay. Beschikbaar op: hygiene.edu.uy



Niemand heeft nog op dit artikel gereageerd.