
Kaliumthiocyanaat (KSCN) structuur, eigenschappen, gebruik

De kaliumthiocyanaat Het is een anorganische verbinding die wordt gevormd door de elementen kalium (K), zwavel (S), koolstof (C) en stikstof (N). De chemische formule is KSCN. Het is een kleurloze of witte vaste stof die zeer oplosbaar is in water. Het bestaat uit een kalium-K-ion+ en een SCN-thiocyanaation-. KSCN wordt overvloedig in speeksel aangetroffen.
Kaliumthiocyanaat wordt gebruikt als laboratoriumreagens voor verschillende soorten chemische analyse. Het wordt ook gebruikt in inkt en verf.

KSCN is gebruikt om dentinegelatine (materiaal onder tandglazuur) op te lossen voordat tandreparatiemateriaal of hars wordt aangebracht. Het wordt ook gebruikt bij onderzoek naar vaccins, omdat het de extractie van bepaalde biochemische elementen uit bacteriën mogelijk maakt.
Het wordt gebruikt in de vorm van een oplossing waarbij metalen oplossen tijdens het polijstproces door middel van elektriciteit of elektrolytisch polijsten. Het is ook gebruikt bij het verkrijgen van nepbloed voor films en toneelstukken.
Het wordt soms misbruikt om de stabiliteit van melk te verhogen wanneer deze niet gekoeld wordt bewaard. Maar het heeft het nadeel dat het hypothyreoïdie veroorzaakt, een ziekte waarbij de schildklier niet goed functioneert..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Ontledingstemperatuur
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 3,7 pH
- 3.8 Overige eigenschappen
- 4 Verkrijgen
- 4.1 Aanwezigheid in de natuur
- 5 toepassingen
- 5.1 In verschillende toepassingen
- 5.2 Bij tandheelkundige toepassingen
- 5.3 In medische wetenschappelijke laboratoria
- 5.4 In de metaalindustrie
- 5.5 Op de set van films of in de bioscoop
- 5.6 Misbruik van kaliumthiocyanaat
- 6 Risico's
- 7 referenties
Structuur
Kaliumthiocyanaat bestaat uit een kalium K-kation+ en een NCS-thiocyanaatanion-. De laatste wordt gevormd door een stikstof (N) verbonden aan een koolstof (C) via een drievoudige binding en een zwavel (S) bevestigd aan koolstof via een enkele binding.
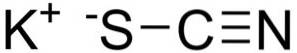
Nomenclatuur
- Kaliumthiocyanaat
- Kaliumsulfocyanaat
- Kaliumzout van thiocyaanzuur
- Kalium Rhodanaat
- Kaliumrodanide
Eigendommen
Fysieke toestand
Kleurloze of witte vaste stof.
Molecuulgewicht
97,18 g / mol
Smeltpunt
173 ºC
Ontledingstemperatuur
500 ºC
Dichtheid
1,88 g / cm3
Oplosbaarheid
Zeer goed oplosbaar in water: 217 g / 100 ml bij 20 ° C, 238 g / 100 ml bij 25 ° C. Oplosbaar in ethanol.
pH
Een 5% -oplossing van KSCN heeft een pH tussen 5,3 en 8,7.
Andere eigenschappen
Zuivere, droge kaliumthiocyanaatmonsters zijn voor onbepaalde tijd stabiel als ze in het donker worden bewaard in goed afgedekte glazen potten. In contact met direct zonlicht worden de kleurloze kristallen echter snel gelig..
Oplossingen van puur KSCN-zout beschermd tegen licht zijn volledig stabiel.
KSCN kan gelatine en collageen doen zwellen. Waterige oplossingen van kaliumthiocyanaat bij reactie met mangaandioxide MnOtwee oxideren en vormen thiocyanogeen (SCN)twee.
Het verkrijgen van
Kaliumthiocyanaat kan worden bereid door kaliumcyanide (KCN) te smelten met zwavel (S). De reactie is snel en kwantitatief.
KCN + S → KSCN
Het kan in oplossing worden verkregen door zwavel (S) op te lossen in benzeen of aceton en een oplossing van kaliumcyanide (KCN) in isopropanol toe te voegen. Deze reactie wordt gebruikt om de hoeveelheid zwavel in een oplossing te analyseren.
Kaliumthiocyanaat kan zuiver worden verkregen door opeenvolgende herkristallisaties uit water of ethanol..
Aanwezigheid in de natuur
Kaliumthiocyanaat wordt overvloedig in speeksel aangetroffen (15 mg / dL), maar is afwezig in het bloed.
Ook de melk van sommige zoogdieren (zoals koeien) bevat van nature zeer kleine hoeveelheden thiocyanaat.
Toepassingen
In verschillende toepassingen
Kaliumthiocyanaat is gebruikt in verschillende chemische analyses. Het is gebruikt voor de analyse of titratie van zilverionen, ook als reagens en indicator voor andere analyses.
KSCN wordt gebruikt in kleurstoffen en pigmenten. Gebruikt in verven en inkten.
In de fotografie-industrie wordt het vooral gebruikt bij de vervaardiging van fotofilms, omdat het dient om de stevige afzetting van gelatine uit plastic films mogelijk te maken..
De concentratie van thiocyanaat in bloed is gebruikt in medisch-wetenschappelijke experimenten om de mate waarin sommige mensen roken te bepalen, aangezien thiocyanaat een product is dat is afgeleid van waterstofcyanide (HCN) dat aanwezig is in tabaksrook..
Bij tandheelkundige toepassingen
Kaliumthiocyanaat is gebruikt bij het herstel van dierentanden. Het is met succes aangebracht op het tandbeenoppervlak als voorbehandeling voordat het middel wordt aangebracht om het open gat te vullen of te dichten.
Dentine is de laag die wordt aangetroffen onder het glazuur van de tanden.
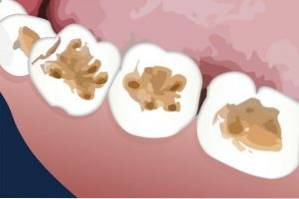
Kaliumthiocyanaat bevordert de zwelling van de gelatine die zich op het dentine bevindt, zodat deze laag gemakkelijk kan worden verwijderd en een betere hechting of hechting van het materiaal dat de tand (hars) afdicht, het resultaat is..
In medische wetenschappelijke laboratoria
KSCN wordt gebruikt bij de bereiding van vaccins of bacteriële extracten.
De pathogene bacteriën worden gekweekt door incubatie in geschikte laboratoriumcontainers. Vervolgens worden een fosfaat pH-regelaar en KSCN toegevoegd aan de container waar de bacteriecultuur zich bevindt..
Een deel van dit bacteriële preparaat wordt genomen en in een potje gedaan. Het wordt een geschikte tijd geroerd en de suspensie wordt gecentrifugeerd om de vloeistof van het vaste materiaal te scheiden. De bovenstaande vloeistof (vloeistof) wordt verzameld en gedialyseerd.
Het resultaat is een extract dat wordt gebruikt om te vaccineren bij wetenschappelijke experimenten met proefdieren..
In de metaalindustrie
Kaliumthiocyanaat wordt gebruikt bij het elektrolytisch polijsten van metalen. Elektrolytisch polijsten is een chemisch proces waarmee het oppervlak van een metaal kan worden behandeld om de micro-ruwheid te verminderen, dat wil zeggen om het metalen oppervlak glad te maken.
Dit gebeurt met elektriciteit, waardoor het glad te strijken metaal dienst doet als positieve pool of anode van de elektrolytische cel. De ruwheid lost op in de kaliumthiocyanaatoplossing en het metaal wordt daardoor gladder.
Op de set van films of in het theater
De KSCN wordt gebruikt bij de simulatie van bloed in film- en televisiefilms of in toneelstukken.
Er wordt bijvoorbeeld een oplossing van kaliumthiocyanaat (KSCN) aangebracht op het gebied van het lichaam dat de snee of gesimuleerde aanval zal "lijden". Het plastic mes of het gesimuleerde snijobject wordt ondergedompeld in een oplossing van ijzerchloride (FeCl3.
Het "scherpe" object met FeCl wordt voorzichtig gepasseerd3 op huid bevochtigd met KSCN. Onmiddellijk zal er een rode streep of vlek ontstaan die sterk lijkt op die van bloed.
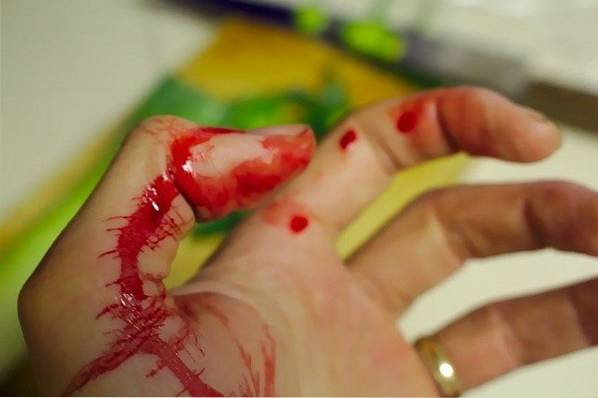
Dit komt door de vorming van een complex van ijzer (III) thiocyanaat en water [Fe (NCS) (HtweeOF)5twee+ die een intens rode kleur heeft die sterk lijkt op bloed:
KSCN + FeCl3 + 5 uurtweeO → [Fe (NCS) (HtweeOF)5twee+ + 2 Cl- + KCl

Misbruik van kaliumthiocyanaat
Kaliumthiocyanaat wordt gewetenloos gebruikt om te voorkomen dat melk wordt aangetast door bacteriën of schimmels, zijn eigenschappen verliest en bederft.
In tropische landen wordt een methode gebruikt genaamd "lacto-peroxidase-systeem" of LP-systeem, die de stabiliteit van melk verhoogt wanneer deze wordt bewaard bij hoge omgevingstemperaturen, wanneer koeling niet mogelijk is..

Deze methode maakt gebruik van het natuurlijke antibacteriële systeem van melk, dat wordt geactiveerd door de concentratie van thiocyanaat (al in kleine hoeveelheden aanwezig in melk) en waterstofperoxide (HtweeOFtwee.
Deze methode is echter in veel landen niet toegestaan door de autoriteiten die bewerkte voedingsmiddelen reguleren..
Sommige gewetenloze mensen voegen KSCN irrationeel toe aan melk met of zonder H.tweeOFtwee, wat een gevaar vormt voor de gezondheid van de consument, aangezien thiocyanaten stoffen zijn die de schildklier beschadigen en bij inname in hoge concentraties hypothyreoïdie kunnen veroorzaken.

Risico's
Het inademen van kaliumthiocyanaatpoeder moet worden vermeden. Het is raadzaam om handschoenen en een veiligheidsbril te gebruiken bij het hanteren ervan. Na een korte blootstelling aan kaliumthiocyanaat kan het effecten op het zenuwstelsel veroorzaken, zoals overmatige emotie zonder motief, agitatie en toevallen..
Na langdurige blootstelling kunnen de schildklier en het centrale zenuwstelsel worden aangetast, wat zich manifesteert in respectievelijk hypothyreoïdie en verslechtering van sommige functies. Bij inslikken kan het verwarring, misselijkheid, braken, toevallen en zwakte veroorzaken..
Bij het ontsteken of verbranden van de KSCN komen zeer giftige cyanidegassen vrij; dit gebeurt ook bij het toevoegen van zuren. In het laboratorium moet het worden behandeld in een goed geventileerde zuurkast..
Referenties
- Jarvinen, L.Z. et al. (1998). Inductie van beschermende immuniteit bij konijnen door gelijktijdige toediening van geïnactiveerd Pasteurella multocida Toxine en kaliumthiocyanaat-extract. Infection and Immunity, aug. 1998, p. 3788-3795. Opgehaald van ncbi.nlm.nih.gov.
- Tani, Y. en Togaya, T. (1995). Dentine Oppervlaktebehandeling zonder zuren. Dental Materials Journal 14 (1): 58-69, 1995. Opgehaald van jstage.jst.go.jp.
- Kolthoff, I.M. en Lingane, J.J. (1935). Kaliumthiocyanaat als een primaire standaardstof. Journal of the American Chemical Society 1935, 57, 11, 2126-2131. Opgehaald van pubs.acs.org.
- Balmasov, A.V. et al. (2005). Elektrolytisch polijsten van zilver in water-organische oplossingen van kaliumthiocyanaat. Prot Met 41, 354-357 (2005). Opgehaald van link.springer.com.
- Cotton, F. Albert en Wilkinson, Geoffrey. (1980). Geavanceerde anorganische chemie. Vierde druk. John Wiley & Sons.
- Lide, D.R. (redacteur) (2003). CRC Handbook of Chemistry and Physics. 85th CRC Press.
- Tyner, T. en Francis, J. (2017). Kaliumthiocyanaat. ACS Reagent Chemicals. Opgehaald van pubs.acs.org.
- Kanthale, P. et al. (2015). Kwalitatieve test voor de detectie van vreemd thiocyanaat in melk. J Food Sci Technol (maart 2015) 52 (3): 1698-1704. Opgehaald van ncbi.nlm.nih.gov.
- Roy, D. et al. (2018) Silicium Quantum Dot-gebaseerde fluorescerende sonde: synthesekarakterisering en herkenning van thiocyanaat in menselijk bloed. ACS Omega 2018, 3, 7, 7613-7620. Opgehaald van pubs.acs.org.
- Gammon, K. (2018). De wetenschap van nepbloed. Inside Science. Opgehaald van insidescience.org.


Niemand heeft nog op dit artikel gereageerd.