
Soorten chemische bindingen

Chemische bindingen zijn de krachten die atomen bij elkaar houden om de moleculen te vormen. Er zijn drie soorten bindingen tussen atomen:
- Metalen binding.
- Ionbinding.
- Covalente binding: niet-polair, polair, enkelvoudig, dubbel, drievoudig, datief.
Dankzij deze bindingen worden alle verbindingen die in de natuur voorkomen, gevormd. Er zijn ook krachten die moleculen bij elkaar houden, bekend als intermoleculaire bindingen, zoals:
- Waterstofbruggen of -bruggen.
- Dipool-dipoolkrachten.
Vervolgens leggen we elk van deze links uit.
| Soorten chemische binding | Kenmerkend | Voorbeelden | |
|---|---|---|---|
| Metaal | Metaalionen drijven in een zee van bewegende elektronen. | Metaalelementen: natrium, barium, zilver, ijzer, koper. | |
| Ionisch | Overdracht van elektronen van het ene atoom naar het andere. | Natriumchloride Na+Cl- | |
| Covalent | Niet polair | Deel elektronen gelijkmatig tussen twee atomen. | Moleculaire waterstof H-H of Htwee |
| Polair | Deel elektronen ongelijk tussen twee atomen. | Watermolecuul HtweeOF | |
| Gemakkelijk | Deel een paar elektronen. | Chloor molecuul Cltwee Cl-Cl | |
| Dubbele | Deel twee paar elektronen. | Zuurstofmolecuul Otwee O = O | |
| Verdrievoudigen | Deel drie paar elektronen. | Stikstofmolecuul N≣N of Ntwee | |
| Datief | Slechts één van de atomen deelt de elektronen. | Binding tussen stikstof en boor in de verbinding ammoniak-boortrifluoride. | |
| Intermoleculaire krachten | Waterstofbrug | De waterstofatomen van een molecuul worden aangetrokken door de elektronegatieve atomen van een ander molecuul. | Waterstofbindingen tussen de waterstof van een watermolecuul met de zuurstof van een ander watermolecuul. |
| Dipool-dipool | Moleculen met twee elektrische polen trekken de tegenovergestelde polen van andere moleculen aan. | Interacties tussen methanal H-moleculentweeC = O | |
Metalen binding
De metalen binding is de aantrekkingskracht tussen de positieve ionen van de metalen elementen en de negatieve elektronen die vrij bewegen tussen de ionen. Metaalatomen zijn dicht opeengepakt, hierdoor kunnen elektronen binnen het rooster van atomen bewegen.
In metalen komen de valentie-elektronen vrij uit hun oorspronkelijke atoom en vormen ze een "zee" van elektronen die rond de hele metalen structuur zweeft. Hierdoor veranderen de metaalatomen in positief geladen metaalionen die zich samenpakken..
De metaalverbinding wordt tot stand gebracht tussen metaalelementen zoals natrium Na, barium Ba, calcium Ca, magnesium Mg, goud Au, zilver Ag en aluminium Al.
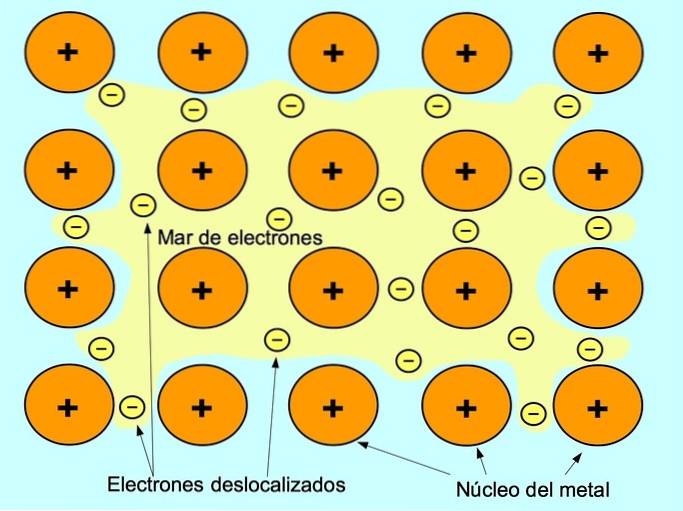
Ionbinding
De ionische binding is de kracht die een metalen element, zoals natrium of magnesium, verbindt met een niet-metalen element, zoals chloor of zwavel. Het metaal verliest elektronen en verandert in een positief genoemd metaalion kation. Deze elektronen gaan naar het niet-metalen element en het verandert in een negatief geladen ion genaamd anion.
De kationen en anionen combineren en vormen een driedimensionaal netwerk dat in stand wordt gehouden door de elektrostatische aantrekkingskracht tussen de ionen met verschillende ladingen. Deze krachten vormen ionische verbindingen.
De aardkorst bestaat voornamelijk uit ionische verbindingen. De meeste rotsen, mineralen en edelstenen zijn ionische verbindingen. Bijvoorbeeld:
- Natriumchloride NaCl: het metallische element is natrium dat een elektron overbrengt naar chloor, het niet-metallische element.
- Magnesiumchloride MgCltwee: Magnesium Mg schenkt twee elektronen aan twee chlooratomen, zoals weergegeven in de onderstaande afbeelding:
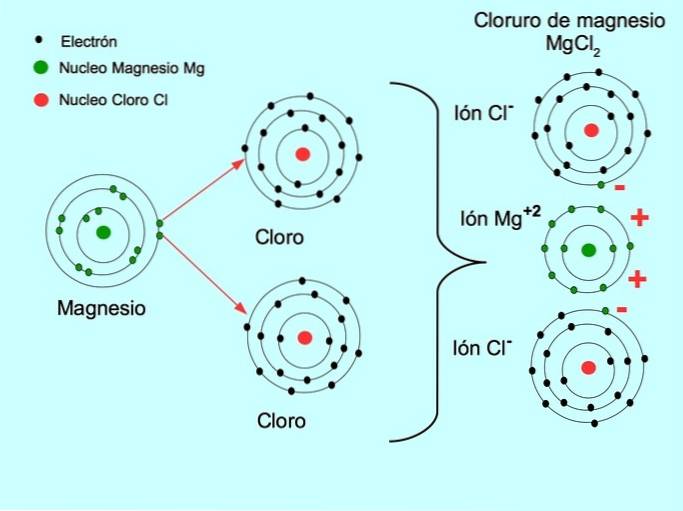
Zie ook Verschil tussen kationen en anionen.
Covalente binding
De covalente binding vormt zich wanneer twee niet-metalen atomen elektronen delen. Deze binding kan van verschillende typen zijn, afhankelijk van de affiniteit voor de elektronen van de atomen en het aantal gedeelde elektronen.
Niet-polaire covalente binding
De niet-polaire covalente binding is de binding die ontstaat tussen twee atomen waar elektronen gelijkelijk worden gedeeld. Deze binding komt normaal voor in symmetrische moleculen, dat wil zeggen moleculen die uit twee gelijke atomen bestaan, zoals het waterstofmolecuul Htwee en het zuurstofmolecuul Otwee.
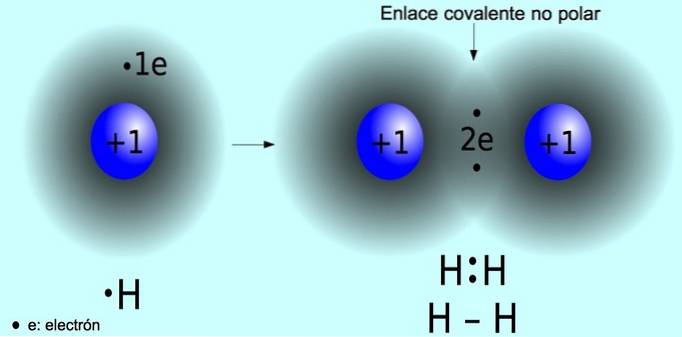
Polaire covalente binding
De polaire covalente binding wordt gevormd wanneer twee atomen elektronen delen, maar een van hen heeft een grotere aantrekkingskracht voor elektronen. Hierdoor heeft het molecuul een meer negatieve "pool" met een groter aantal elektronen en is de tegenoverliggende pool positiever..
Moleculen met deze verdeling of onbalans van elektronen staan bekend als polair. In HF-waterstoffluoride is er bijvoorbeeld een covalente binding tussen waterstof en fluor, maar fluor heeft een hogere elektronegativiteit, dus het trekt gedeelde elektronen sterker aan..
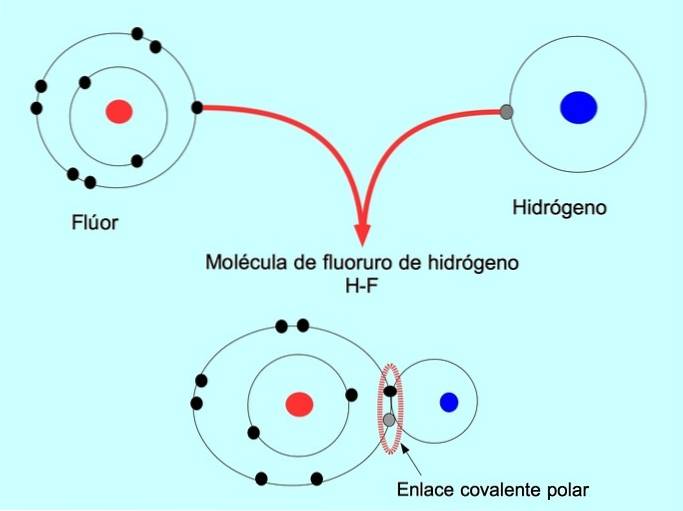
Eenvoudige covalente band
Wanneer twee atomen twee elektronen delen, één van elk, wordt de gevormde covalente binding een eenvoudige covalente binding genoemd.
Chloor is bijvoorbeeld een atoom met zeven valentie-elektronen in de buitenste schil, die kan worden gevuld met acht elektronen. Een chloor kan worden gecombineerd met een ander chloor om het chloormolecuul Cl te vormentwee wat veel stabieler is dan alleen chloor.
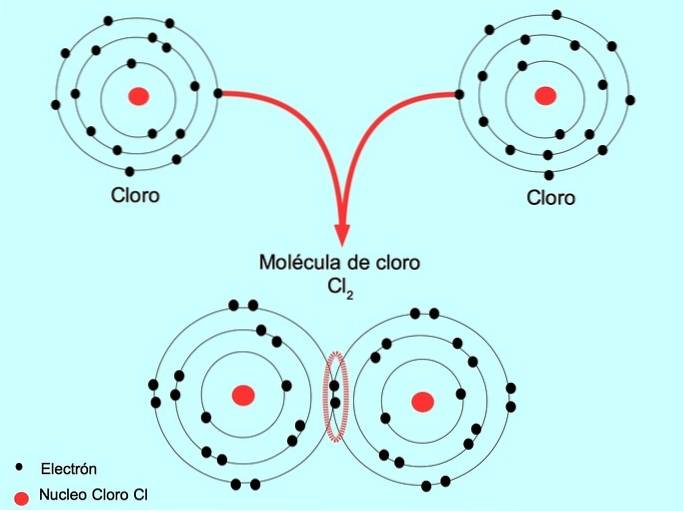
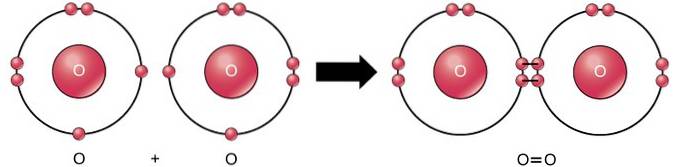
Dubbele covalente binding
De dubbele covalente binding is de binding waarbij vier elektronen (twee paar) elektronen worden gedeeld tussen twee atomen. Zuurstof heeft bijvoorbeeld 6 elektronen in zijn laatste schaal. Wanneer twee zuurstofatomen worden gecombineerd, worden vier elektronen gedeeld tussen de twee, waardoor elk 8 elektronen in de laatste schaal heeft..
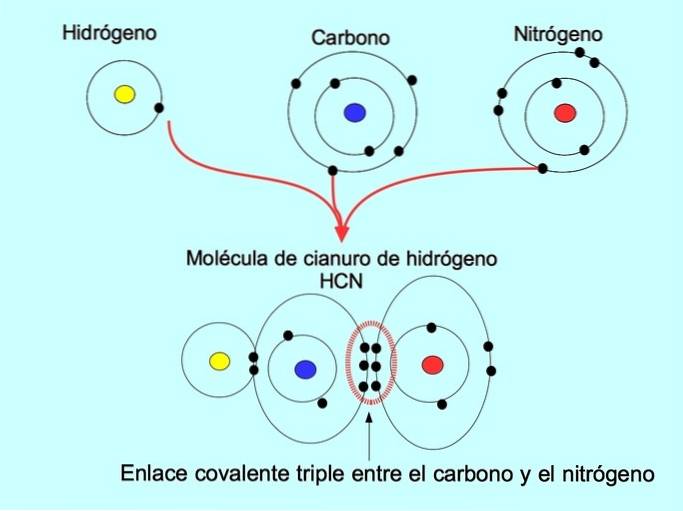
Drievoudige covalente binding
De drievoudige covalente binding wordt gevormd wanneer 6 elektronen (of drie paren) worden gedeeld tussen twee atomen. In het waterstofcyanidemolecuul HCN wordt bijvoorbeeld een drievoudige binding gevormd tussen koolstof en stikstof, zoals weergegeven in de onderstaande afbeelding:
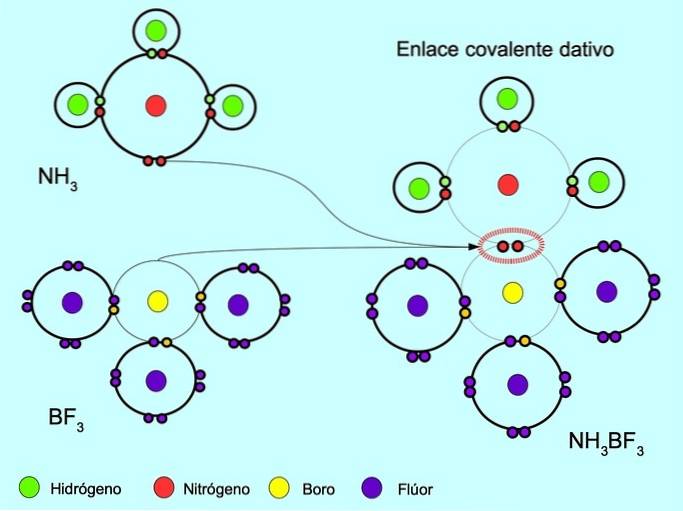
Coördinaten of datief covalente binding
De gecoördineerde of datieve covalente binding is de binding die ontstaat wanneer slechts een van de atomen in de binding een paar elektronen bijdraagt. Bijvoorbeeld wanneer ammoniak NH reageert3 met boortrifluoride BF3, Stikstof bindt zich met twee elektronen rechtstreeks aan boor, dat geen beschikbare elektronen heeft om te delen. Op deze manier blijven zowel stikstof als boor achter met 8 elektronen in hun valentieschil..
Zie ook organische en anorganische verbindingen.
Intermoleculaire links
Moleculen associëren zich door krachten die het mogelijk maken om stoffen in vloeibare of vaste toestand te vormen.
Dipool-dipool bindingen of krachten
Zwakke intermoleculaire bindingen kunnen tot stand worden gebracht tussen polaire moleculen wanneer negatieve polen worden aangetrokken door positieve polen en vice versa. Bijvoorbeeld methanal HtweeC = O is een polair molecuul, met een gedeeltelijke negatieve lading op zuurstof en een gedeeltelijke positieve lading op waterstofatomen. De positieve kant van een methanalmolecuul trekt de negatieve kant van een ander methanalmolecuul aan.
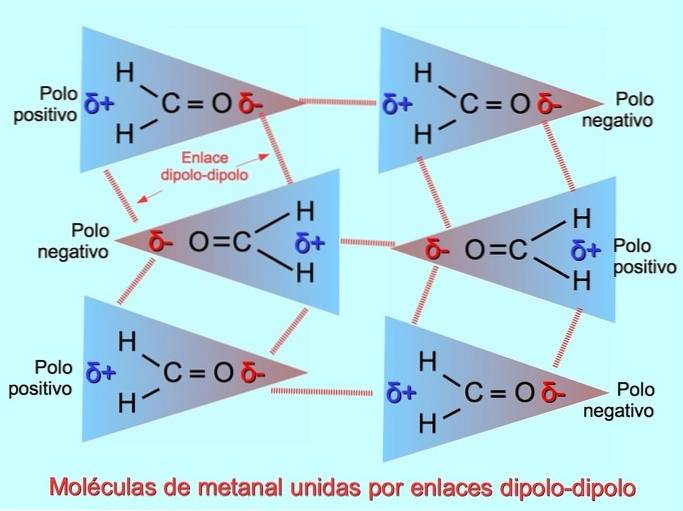
Waterstofbruggen of -bruggen
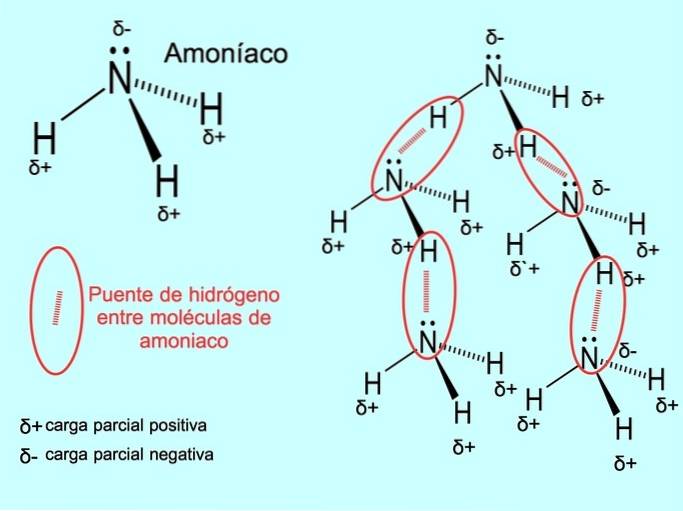
De waterstofbrug of waterstofbrug is een binding die tot stand wordt gebracht tussen moleculen. Het treedt op wanneer een waterstof in het molecuul covalent gebonden is aan een zuurstof, een stikstof of een fluor. Zuurstof, stikstof en fluor zijn atomen met een hogere elektronegativiteit, daarom trekken ze elektronen sterker aan wanneer ze deze delen met een ander, minder elektronegatief atoom..
Er zijn waterstofbruggen tussen watermoleculen H.tweeO en NH ammoniak3 zoals de foto laat zien:
Wellicht bent u geïnteresseerd in:
- Atomen en moleculen.
- Voorbeelden van organische en anorganische verbindingen.
Referenties
Zumdahl, S.S., Zumdahl, S.A. (2014) Scheikunde. Negende editie. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5e editie. Pearson Australië. Melbourne.


Niemand heeft nog op dit artikel gereageerd.