
Titina-structuur, functies en gerelateerde pathologieën
Titina is de term die wordt gebruikt om een paar gigantische polypeptideketens te beschrijven die het derde meest voorkomende eiwit vormen in de sarcomeren van een breed scala aan skelet- en hartspieren.
Titine is een van de grootste bekende eiwitten in termen van het aantal aminozuurresiduen en dus in termen van molecuulgewicht. Dit eiwit is ook bekend als connectin en is aanwezig bij zowel gewervelde dieren als ongewervelde dieren.
Het werd voor het eerst met deze naam (connectin) beschreven in 1977 en in 1979 werd het gedefinieerd als de dubbele band in het bovenste deel van een polyacrylamidegelelektroforesegel onder denaturerende omstandigheden (met natriumdodecylsulfaat). In 1989 werd de locatie vastgesteld door middel van immuno-elektronenmicroscopie.
Samen met een ander groot eiwit, nebuline, is titine een van de belangrijkste componenten van het elastische netwerk van het spiercelcytoskelet dat naast de dikke filamenten (myosine) en de dunne filamenten (actine) in de sarcomeren bestaat; zozeer zelfs dat het bekend staat als het derde filamentsysteem van spiervezels.
De dikke en dunne filamenten zijn verantwoordelijk voor het genereren van de actieve kracht, terwijl de titinefilamenten de visco-elasticiteit van de sarcomeren bepalen..
Een sarcomeer is de zich herhalende eenheid van myofibrillen (spiervezels). Het is ongeveer 2 μm lang en wordt begrensd door 'platen' of lijnen die Z-lijnen worden genoemd, die elke myofibril in gestreepte fragmenten van gedefinieerde grootte segmenteren.
Titinemoleculen assembleren tot extreem lange, flexibele, dunne en rekbare draadvormige strengen. Titine is verantwoordelijk voor de elasticiteit van skeletspieren en wordt verondersteld te functioneren als een moleculaire scaffold die de juiste assemblage van sarcomeren in myofibrillen specificeert..
Artikel index
- 1 Structuur
- 2 functies
- 2.1 Overige functies
- 3 Gerelateerde pathologieën
- 4 referenties
Structuur
Bij gewervelde dieren heeft titine ongeveer 27.000 aminozuurresiduen en een molecuulgewicht van ongeveer 3 MDa (3.000 kDa). Het is samengesteld uit twee polypeptideketens die bekend staan als T1 en T2, die vergelijkbare chemische samenstellingen en vergelijkbare antigene eigenschappen hebben..
In de spier van ongewervelde dieren zijn de "mini-titines”Met een molecuulgewicht tussen 0,7 en 1,2 MDa. Deze groep eiwitten omvat het eiwit "Twitchina" van Caenorhabditis elegans en proteïne "Projectin" gevonden in genre Drosophila.
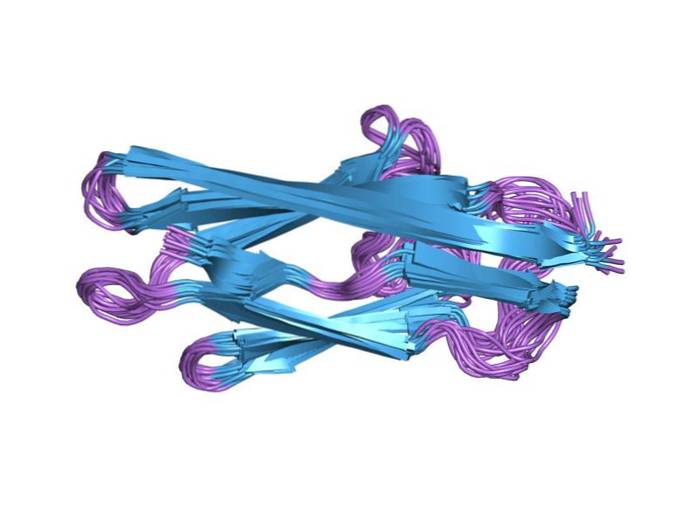
Gewervelde titine is een modulair eiwit dat voornamelijk bestaat uit immunoglobuline en fibronectine III-achtige domeinen (FNIII-Leuk vinden) in batch gerangschikt. Het heeft een elastisch gebied dat rijk is aan proline-, glutaminezuur-, valine- en lysineresiduen, bekend als het PEVK-domein, en een ander serinekinasedomein aan het carboxyluiteinde ervan..
Elk van de domeinen is ongeveer 100 aminozuren lang en staat bekend als klasse I-titine (het fibronectine-achtige domein III) en klasse II-titine (het immunoglobuline-achtige domein). Beide domeinen vouwen in 4 nm lange "sandwich" -structuren die zijn samengesteld uit antiparallelle β-vellen..
Het cardiale connectinemolecuul bevat 132 herhalingsmotieven van het immunoglobulinedomein en 112 herhalingsmotieven van het fibronectine III-achtige domein..
Het coderende gen voor deze eiwitten (TTN) is de "kampioen" van introns, aangezien het er bijna 180 van binnen heeft.
De transcripten van de subeenheden worden differentieel verwerkt, vooral de coderende gebieden van de immunoglobuline (Ig) en PEVK-achtige domeinen, die aanleiding geven tot isovormen met verschillende uitbreidbare eigenschappen..
Kenmerken
De functie van titine in sarcomeren hangt af van de associatie met verschillende structuren: het C-terminale uiteinde is verankerd aan de M-lijn, terwijl het N-terminale uiteinde van elke titine is verankerd aan de Z-lijn..
De nebuline- en titine-eiwitten fungeren als "moleculaire linialen" die respectievelijk de lengte van de dikke en dunne filamenten regelen. Titin, zoals vermeld, strekt zich uit van de Z-schijf tot voorbij de M-lijn, in het midden van de sarcomeer, en reguleert de lengte ervan, waardoor overstrekking van de spiervezel wordt voorkomen..
Het is aangetoond dat het vouwen en ontvouwen van titine het spiercontractieproces ondersteunt, dat wil zeggen, het genereert het mechanische werk dat het inkorten of verlengen van de sarcomeren bewerkstelligt; terwijl dikke en dunne vezels de moleculaire bewegingsmotoren zijn.
Titin neemt deel aan het onderhoud van de dikke filamenten in het midden van het sarcomeer en zijn vezels zijn verantwoordelijk voor het genereren van passieve spanning tijdens het strekken van de sarcomeren..
Andere functies
Naast zijn deelname aan het genereren van de visco-elastische kracht, heeft titin nog andere functies, waaronder:
-Deelname aan mechano-chemische signaleringsgebeurtenissen door de associatie met andere sarcomere en niet-sarcomere eiwitten
-Lengte-afhankelijke activering van het contractiele apparaat
-Sarcomere vergadering
-Bijdrage aan de structuur en functie van het cytoskelet bij onder meer gewervelde dieren.
Bepaalde studies hebben aangetoond dat in menselijke cellen en embryo's van Drosophila, titine heeft nog een andere functie als chromosomaal eiwit. De elastische eigenschappen van het gezuiverde eiwit komen perfect overeen met de elastische eigenschappen van de chromosomen van zowel levende cellen als geassembleerde chromosomen. in vitro.
De deelname van dit eiwit aan de verdichting van chromosomen is aangetoond dankzij plaatsgerichte mutagenese-experimenten van het gen dat ervoor codeert, wat resulteert in zowel spier- als chromosomale defecten..
Lange et al. Toonden in 2005 aan dat het titinekinasedomein te maken heeft met het complexe expressiesysteem van spiergenen, een feit aangetoond door de mutatie van dit domein die erfelijke spierziekten veroorzaakt.
Gerelateerde pathologieën
Sommige hartaandoeningen worden in verband gebracht met veranderingen in de elasticiteit van titine. Dergelijke veranderingen hebben een grote invloed op de rekbaarheid en passieve diastolische stijfheid van het myocardium en, vermoedelijk, op mechanogevoeligheid..
De Gen TTN is geïdentificeerd als een van de belangrijkste genen die betrokken zijn bij ziekten bij de mens, dus de eigenschappen en functies van cardiale eiwitten zijn de afgelopen jaren uitgebreid bestudeerd.
Verwijde cardiomyopathie en hypertrofische cardiomyopathie zijn ook het product van de mutatie van verschillende genen, waaronder het gen TTN.
Referenties
- Despopoulos, A., & Silbernagl, S. (2003). Kleurenatlas van de fysiologie (5e ed.). New York: Thieme.
- Herman, D., Lam, L., Taylor, M., Wang, L., Teekakirikul, P., Christodoulou, D.,… Seidman, C. E. (2012). Afknotting van titine die verwijde cardiomyopathie veroorzaken. The New England Journal of Medicine, 366(7), 619-628.
- Keller, T. (1995). Structuur en functie van titine en nebuline. Huidige mening in de biologie, 7, 32-38.
- Lange, S., Lange, S., Xiang, F., Yakovenko, A., Vihola, A., Hackman, P.,… Gautel, M. (2005). Het kinase-domein van titine regelt spiergenexpressie en eiwitomzet. Wetenschap, 1599-1603.
- Linke, W. A., en Hamdani, N. (2014). Gigantische zaken: Titin-eigenschappen en functie door dik en dun. Circulatieonderzoek, 114, 1052-1068.
- Machado, C., en Andrew, D. J. (2000). D-TITIN: een gigantisch eiwit met dubbele rollen in chromosomen en spieren. The Journal of Cell Biology, 151(3), 639-651.
- Maruyama, K. (1997). Gigantisch elastisch eiwit van spieren. Het FASEB Journal, elf, 341-345.
- Nelson, D. L., en Cox, M. M. (2009). Lehninger-principes van biochemie. Omega-edities (5e ed.).
- Rivas-Pardo, J., Eckels, E., Popa, I., Kosuri, P., Linke, W., & Fernández, J. (2016). Werk gedaan door titine-eiwitvouwing helpt bij het samentrekken van de spieren. Celrapporten, 14, 1339-1347.
- Trinick, J. (1994). Titine en nebuline: eiwitlinialen in spieren? Trends in biochemische wetenschappen, 19, 405-410.
- Tskhovrebova, L., en Trinick, J. (2003). Titin: Eigenschappen en familierelaties. Nature beoordelingen, 4, 679-6889.
- Wang, K., Ramirez-Mitchell, R., en Palter, D. (1984). Titin is een buitengewoon lang, flexibel en dun myofibrillair eiwit. Proc. Natl. Acad. Sci., 81, 3685-3689.



Niemand heeft nog op dit artikel gereageerd.