
Koolstofatoomkenmerken, structuur, hybridisatie

De koolstofatoom het is misschien wel het belangrijkste en meest symbolische van alle elementen, want dankzij het is het bestaan van leven mogelijk. Het omsluit in zichzelf niet alleen een paar elektronen, of een kern met protonen en neutronen, maar ook sterrenstof, dat uiteindelijk wordt opgenomen en levende wezens vormt..
Evenzo worden koolstofatomen gevonden in de aardkorst, hoewel niet in overvloed vergelijkbaar met metaalelementen zoals ijzer, carbonaten, kooldioxide, olie, diamanten, koolhydraten, enz., Ze maken deel uit van de fysische en chemische manifestaties ervan..
Maar hoe is het koolstofatoom? Een eerste onnauwkeurige schets is te zien in de afbeelding hierboven, waarvan de kenmerken in de volgende sectie worden beschreven.
Koolstofatomen lopen door de atmosfeer, de zeeën, de ondergrond, planten en alle diersoorten. Zijn grote chemische diversiteit is te danken aan de hoge stabiliteit van zijn bindingen en de manier waarop ze in de ruimte zijn gerangschikt. Zo is er aan de ene kant zacht en smerend grafiet; en aan de andere kant de diamant, waarvan de hardheid die van vele materialen overtreft.
Als het koolstofatoom niet de eigenschappen zou hebben die het karakteriseren, zou organische chemie niet volledig bestaan. Sommige visionairs zien erin de nieuwe materialen van de toekomst, door het ontwerp en de functionalisering van hun allotrope structuren (koolstofnanobuisjes, grafeen, fullerenen, enz.).
Artikel index
- 1 Kenmerken van het koolstofatoom
- 2 Structuur
- 3 Hybridisatie
- 3.1 sp3
- 3.2 sp2 en sp
- 4 Classificatie
- 4.1 Primair
- 4.2 Secundair
- 4.3 Tertiair
- 4.4 Kwartair
- 5 toepassingen
- 5.1 Atomaire massa-eenheid
- 5.2 Koolstofcyclus en levensduur
- 5.3 13C NMR-spectroscopie
- 6 referenties
Kenmerken van het koolstofatoom
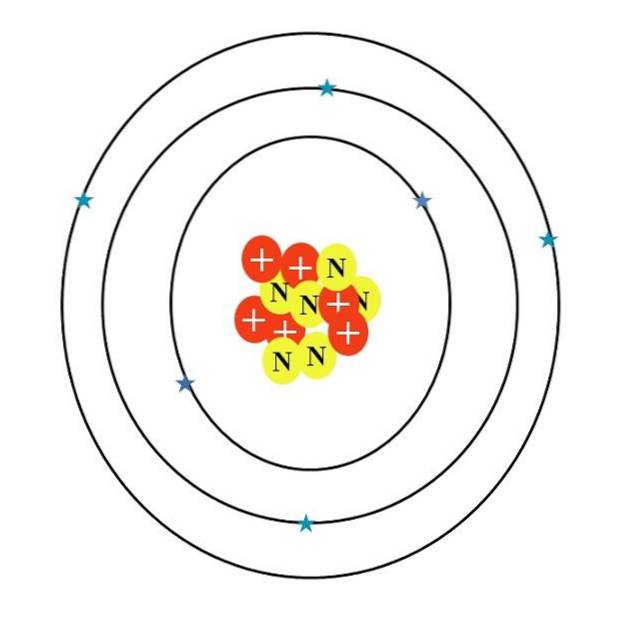
Het koolstofatoom wordt gesymboliseerd door de letter C. Het atoomnummer Z is 6, daarom heeft het zes protonen (rode cirkels met het symbool "+" in de kern). Bovendien heeft het zes neutronen (gele cirkels met de letter "N") en ten slotte zes elektronen (blauwe sterren).
De som van de massa's van zijn atomaire deeltjes geeft een gemiddelde waarde van 12,0107 u. Het atoom in de afbeelding komt echter overeen met de koolstof 12-isotoop (12C), dat bestaat uit d. Andere isotopen, zoals 13C en 14C, minder overvloedig, varieert alleen in het aantal neutronen.
Dus als deze isotopen zijn getekend, is de 13C zou een extra gele cirkel hebben, en de 14C, nog twee. Dit betekent logischerwijs dat het zwaardere koolstofatomen zijn..
Welke andere kenmerken kunnen daarbij nog worden genoemd? Het is vierwaardig, dat wil zeggen, het kan vier covalente bindingen vormen. Het bevindt zich in groep 14 (IVA) van het periodiek systeem, meer bepaald in blok p.
Het is ook een zeer veelzijdig atoom dat zich kan verbinden met bijna alle elementen van het periodiek systeem; vooral met zichzelf, waarbij ze lineaire, vertakte en laminaire macromoleculen en polymeren vormen.
Structuur
Wat is de structuur van een koolstofatoom? Om deze vraag te beantwoorden, moet u eerst naar de elektronische configuratie gaan: 1stwee2 sectwee2 Blztwee of [Hij] 2stwee2 Blztwee.
Daarom zijn er drie orbitalen: de enentwee, de 2stwee en de 2ptwee, elk met twee elektronen. Dit is ook te zien in de afbeelding hierboven: drie ringen met elk twee elektronen (blauwe sterren) (verwar de ringen niet met banen: het zijn orbitalen).
Merk echter op dat twee van de sterren een donkerdere tint blauw hebben dan de overige vier. Waarom? Omdat de eerste twee overeenkomen met de binnenste laag 1stwee of [He], die niet rechtstreeks deelneemt aan de vorming van chemische bindingen; terwijl de buitenste schil elektronen, 2s en 2p, doen.
De s- en p-orbitalen hebben niet dezelfde vorm, dus het geïllustreerde atoom komt niet overeen met de werkelijkheid; naast de grote onevenredigheid van de afstand tussen de elektronen en de kern, die honderden keren groter zou moeten zijn.
Daarom bestaat de structuur van het koolstofatoom uit drie orbitalen waar elektronen "smelten" tot wazige elektronische wolken. En tussen de kern en deze elektronen is er een afstand die het immense "vacuüm" in het atoom onthult..
Hybridisatie
Eerder werd vermeld dat het koolstofatoom vierwaardig is. Volgens de elektronische configuratie zijn de 2s-elektronen gepaard en de 2p-elektronen ongepaard:
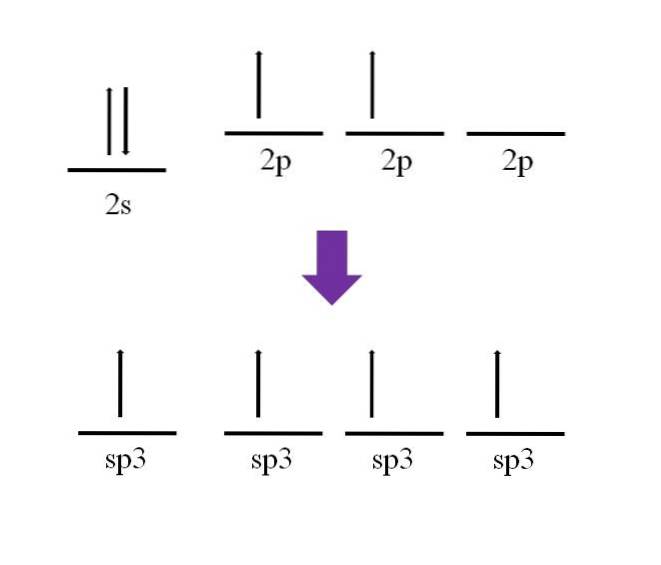
Er is één p-orbitaal beschikbaar, die leeg is en gevuld met een extra elektron op het stikstofatoom (2p3.
Volgens de definitie van de covalente binding is het noodzakelijk dat elk atoom een elektron bijdraagt voor zijn vorming; het is echter te zien dat in de basislijn staat van het koolstofatoom, heeft het slechts twee ongepaarde elektronen (één in elke 2p-orbitaal). Dit betekent dat het in deze toestand een tweewaardig atoom is en daarom slechts twee bindingen vormt (-C-).
Dus hoe is het mogelijk dat het koolstofatoom vier bindingen vormt? Om dit te doen, moet je een elektron promoten van de 2s-orbitaal naar de 2p-orbitaal met hogere energie. Dit gedaan, de resulterende vier orbitalen zijn ontaardenmet andere woorden, ze hebben dezelfde energie of stabiliteit (merk op dat ze uitgelijnd zijn).
Dit proces staat bekend als hybridisatie en dankzij het heeft het koolstofatoom nu vier sp-orbitalen3 met elk één elektron om vier bindingen te vormen. Dit komt door het kenmerk dat het vierwaardig is.
sp3
Wanneer het koolstofatoom een sp-hybridisatie heeft3, oriënteert zijn vier hybride orbitalen naar de hoekpunten van een tetraëder, wat de elektronische geometrie is.
Zo kan men een koolstof sp3 omdat het maar vier eenvoudige bindingen vormt, zoals in het methaanmolecuul (CH4En daaromheen kan een tetraëdrische omgeving worden waargenomen.
De overlap van sp-orbitalen3 het is zo effectief en stabiel dat de enkele C-C-binding een enthalpie heeft van 345,6 kJ / mol. Dit verklaart waarom er eindeloze carbonaatstructuren zijn en een onmetelijk aantal organische verbindingen. Daarnaast kunnen koolstofatomen andere soorten bindingen vormen.
sptwee en sp
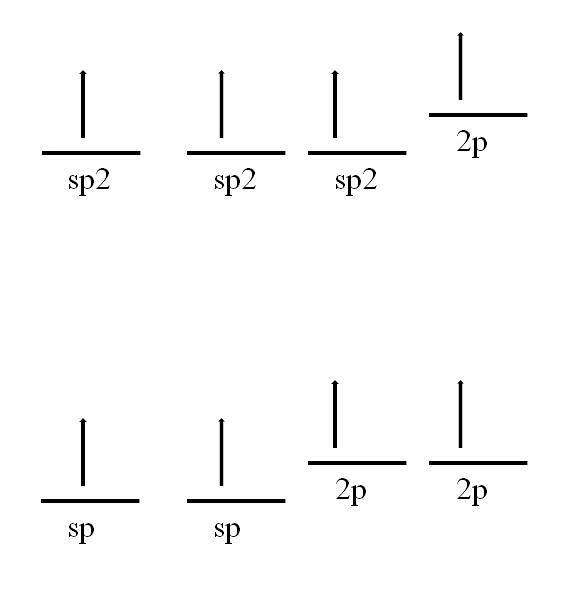
Het koolstofatoom is ook in staat om andere hybridisaties aan te nemen, waardoor het een dubbele of zelfs drievoudige binding kan vormen.
In sp-hybridisatietwee, zoals te zien is in de afbeelding, zijn er drie sp-orbitalentwee gedegenereerd en een 2p-orbitaal blijft ongewijzigd of "puur". Met de drie sp-orbitalentwee 120º uit elkaar, vormt de koolstof drie covalente bindingen die een elektronische geometrie in het trigonale vlak tekenen; terwijl het met de 2p-orbitaal, loodrecht op de andere drie, een π-binding vormt: -C = C-.
In het geval van sp-hybridisatie zijn er twee sp-orbitalen 180º uit elkaar, zodanig dat ze een lineaire elektronische geometrie tekenen. Deze keer hebben ze twee zuivere 2p-orbitalen, loodrecht op elkaar, waardoor de koolstof drievoudige bindingen of twee dubbele bindingen kan vormen: -C≡C- of ·· C = C = C ·· (de centrale koolstof heeft sp-hybridisatie ).
Merk op dat altijd (in het algemeen) als de bindingen rond de koolstof worden toegevoegd, zal blijken dat het aantal gelijk is aan vier. Deze informatie is essentieel bij het tekenen van Lewis-structuren of moleculaire structuren. Een koolstofatoom dat vijf bindingen vormt (= C≡C) is theoretisch en experimenteel niet toelaatbaar.
Classificatie
Hoe worden koolstofatomen geclassificeerd? Het is meer dan een classificatie op basis van interne kenmerken, het hangt eigenlijk af van de moleculaire omgeving. Dat wil zeggen, binnen een molecuul kunnen de koolstofatomen als volgt worden geclassificeerd.
Primair
Een primaire koolstof is er een die slechts aan één andere koolstof is gebonden. Bijvoorbeeld het molecuul ethaan, CH3-CH3 Het bestaat uit twee gebonden primaire koolstofatomen. Dit duidt het einde of begin van een koolstofketen aan.
Ondergeschikt
Het is er een die is gekoppeld aan twee koolstofatomen. Dus voor het propaanmolecuul, CH3-CHtwee-CH3, het middelste koolstofatoom is secundair (de methyleengroep, -CHtwee-.
Tertiair
De tertiaire koolstofatomen verschillen van de rest doordat er takken van de hoofdketen uit voortkomen. Bijvoorbeeld 2-methylbutaan (ook wel isopentaan genoemd), CH3-CH(CH3) -CHtwee-CH3 heeft een tertiaire koolstof die vetgedrukt is.
Kwartair
En tot slot zijn quaternaire koolstofatomen, zoals hun naam al aangeeft, verbonden met vier andere koolstofatomen. Het neopentaan-molecuul, C(CH34 bezit een quaternair koolstofatoom.
Toepassingen
Atomaire massa-eenheid
De gemiddelde atoommassa van de 12C wordt gebruikt als een standaardmaat voor het berekenen van de massa van de andere elementen. Waterstof weegt dus een twaalfde van deze isotoop van koolstof, die wordt gebruikt om te definiëren wat bekend staat als atomaire massa-eenheid u.
De andere atoommassa's kunnen dus worden vergeleken met die van de 12C en de 1H. bijvoorbeeld magnesium (24Mg) weegt ongeveer twee keer het gewicht van een koolstofatoom en 24 keer meer dan een waterstofatoom.
Koolstofcyclus en leven
Planten nemen CO optwee in het fotosyntheseproces om zuurstof in de atmosfeer af te geven en als plantenlongen te fungeren. Als ze doodgaan, veranderen ze in houtskool, dat na verbranding weer CO afgeefttwee. Een deel keert terug naar de planten, maar een ander komt terecht in de zeebodem en voedt veel micro-organismen.
Wanneer de micro-organismen afsterven, blijft de vaste stof achter in zijn biologische afbraaksedimenten, en na miljoenen jaren wordt het omgezet in wat bekend staat als olie..
Wanneer de mensheid deze olie gebruikt als alternatieve energiebron voor het verbranden van steenkool, draagt het bij aan het vrijkomen van meer COtwee (en andere ongewenste gassen).
Aan de andere kant gebruikt het leven koolstofatomen diep van binnen. Dit komt door de stabiliteit van zijn bindingen, waardoor het ketens en moleculaire structuren kan vormen waaruit macromoleculen net zo belangrijk zijn als DNA..
NMR-spectroscopie 13C
De 13C, hoewel het in een veel kleinere verhouding is dan die van de 12C, de overvloed ervan is voldoende om moleculaire structuren op te helderen door middel van koolstof-13 nucleaire magnetische resonantiespectroscopie.
Dankzij deze analysetechniek is het mogelijk om te bepalen welke atomen de 13C en tot welke functionele groepen ze behoren. Zo kan het koolstofskelet van elke organische verbinding worden bepaald..
Referenties
- Graham Solomons T.W., Craig B. Fryhle. Organische chemie. Amines. (10e editie.) Wiley Plus.
- Blake D. (4 mei 2018). Vier kenmerken van koolstof. Hersteld van: sciencing.com
- Royal Society of Chemistry. (2018). Steenkool. Genomen uit: rsc.org
- Evolutie begrijpen. (s.f.). Reis van een koolstofatoom. Hersteld van: evolution.berkeley.edu
- Encyclopædia Britannica. (14 maart 2018). Steenkool. Hersteld van: britannica.com
- Pappas S. (29 september 2017). Feiten over koolstof. Hersteld van: livescience.com


Niemand heeft nog op dit artikel gereageerd.