
Kenmerkende topoisomerasen, functies, typen en remmers
De topoisomerases Ze zijn een soort isomerase-enzymen die de topologie van deoxyribonucleïnezuur (DNA) wijzigen, waardoor zowel het afwikkelen als het oprollen en supercoilen ervan worden gegenereerd..
Deze enzymen spelen een specifieke rol bij het verlichten van torsiestress in DNA, zodat belangrijke processen zoals replicatie, transcriptie van DNA in messenger ribonucleïnezuur (mRNA) en recombinatie van DNA kunnen plaatsvinden..
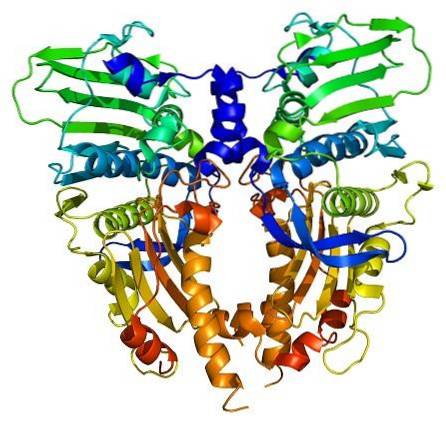
Topoisomerase-enzymen zijn aanwezig in zowel eukaryote als prokaryote cellen. Het bestaan ervan werd voorspeld door wetenschappers Watson en Crick, bij het evalueren van de beperkingen die de structuur van DNA bood om toegang te krijgen tot de informatie (opgeslagen in de nucleotidesequentie).
Om de functies van topoisomerasen te begrijpen, moet men ervan uitgaan dat DNA een stabiele dubbele helixstructuur heeft, met zijn strengen over elkaar gewikkeld..
Deze lineaire ketens bestaan uit 2-deoxyribose verbonden door 5'-3'-fosfodiësterbindingen en stikstofhoudende basen erin, zoals de sporten van een wenteltrap..
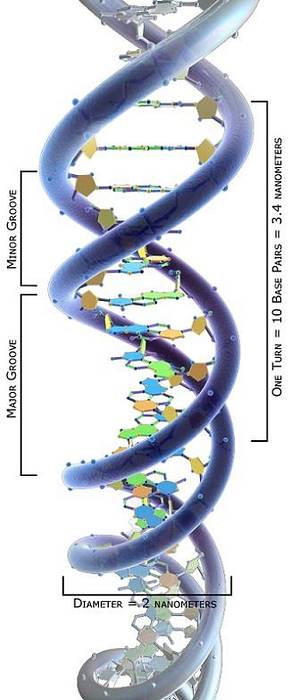
De topologische studie van DNA-moleculen heeft aangetoond dat ze verschillende conformaties kunnen aannemen, afhankelijk van hun torsiespanning: van een ontspannen toestand tot verschillende wikkeltoestanden die hun verdichting mogelijk maken..
DNA-moleculen met verschillende conformaties worden topoisomeren genoemd. We kunnen dus concluderen dat topoisomerasen I en II de torsiespanning van DNA-moleculen kunnen verhogen of verlagen, waarbij ze hun verschillende topoisomeren vormen..
Onder de mogelijke DNA-topoisomeren is de meest voorkomende conformatie de supercoil, die erg compact is. De dubbele DNA-helix moet echter ook worden afgewikkeld door topoisomerasen tijdens verschillende moleculaire processen..
Artikel index
- 1 Kenmerken
- 1.1 Algemeen werkingsmechanisme
- 1.2 Topoisomerasen en de celcyclus
- 2 functies
- 2.1 Compacte opslag van genetisch materiaal
- 2.2 Toegang tot genetische informatie
- 2.3 Regulatie van genexpressie
- 2.4 Bijzonderheden van topoisomerase II
- 3 soorten topoisomerasen
- 3.1-Topoisomerasen type I
- 3.2-Topoisomerases type II
- 3.3 - Menselijke topoisomerasen
- 4 Topoisomerase-remmers
- 4.1 -Topoisomerasen als doelwit van chemische aantasting
- 4.2 -Types van remming
- 4.3 - Topoisomerase-remmers
- 5 referenties
Kenmerken
Algemeen werkingsmechanisme
Sommige topoisomerasen kunnen alleen negatieve supercoils van DNA ontspannen, of beide supercoils van DNA: positief en negatief.
Als het circulaire dubbelstrengs DNA om zijn lengteas wordt afgewikkeld en er een linkshandige draai (met de klok mee) plaatsvindt, wordt gezegd dat het negatief supercoiled is. Als de draai met de klok mee is (tegen de klok in), is deze positief overrollen.

In principe kunnen topoisomerasen:
-Vergemakkelijk de passage van een DNA-streng door een snee in de tegenoverliggende streng (type I topoisomerase).
-Vergemakkelijken van de doorgang van een volledige dubbele helix door een splitsing zelf, of door een splitsing in een andere dubbele helix (type II topoisomerase).
Samenvattend werken topoisomerasen door de splitsing van fosfodiësterbindingen in een of beide strengen waaruit het DNA bestaat. Vervolgens wijzigen ze de wikkelingstoestand van de strengen van een dubbele helix (topoisomerase I) of van twee dubbele helices (topoisomerase II), om uiteindelijk de gespleten uiteinden opnieuw te binden of te binden.
Topoisomerasen en de celcyclus
Hoewel topoisomerase I een enzym is dat een grotere activiteit vertoont tijdens de S-fase (DNA-synthese), wordt het niet geacht afhankelijk te zijn van een fase van de celcyclus..
Terwijl de activiteit van topoisomerase II het meest actief is tijdens de logaritmische fase van celgroei en in cellen van snelgroeiende tumoren.
Kenmerken
De verandering van de genen die coderen voor topoisomerasen is dodelijk voor cellen, wat het belang van deze enzymen aantoont. Onder de processen waaraan topoisomerasen deelnemen, zijn:
Compacte opslag van genetisch materiaal
Topoisomerasen vergemakkelijken de opslag van genetische informatie op een compacte manier, omdat ze het oprollen en supercoilen van DNA genereren, waardoor een grote hoeveelheid informatie in een relatief klein volume kan worden gevonden.
Toegang tot genetische informatie
Zonder topoisomerasen en hun unieke kenmerken zou toegang tot de informatie die in het DNA is opgeslagen onmogelijk zijn. Dit komt door het feit dat topoisomerasen periodiek de torsiespanning loslaten die wordt gegenereerd in de dubbele DNA-helix, tijdens het afwikkelen, in de processen van replicatie, transcriptie en recombinatie..
Als de torsiespanning die tijdens deze processen wordt gegenereerd niet wordt vrijgegeven, kan een defecte genexpressie optreden, de onderbreking van het circulaire DNA of chromosoom, en zelfs celdood veroorzaken.
Regulatie van genexpressie
Conformatieveranderingen (in de driedimensionale structuur) van het DNA-molecuul stellen specifieke gebieden aan de buitenkant bloot, die kunnen interageren met DNA-bindende eiwitten. Deze eiwitten hebben een regulerende functie van genexpressie (positief of negatief).
De oproltoestand van DNA, gegenereerd door de werking van topoisomerasen, beïnvloedt dus de regulatie van genexpressie.
Bijzonderheden van topoisomerase II
Topoisomerase II is nodig voor de assemblage van chromatiden, de condensatie en decondensatie van chromosomen en de segregatie van dochter-DNA-moleculen tijdens mitose..
Dit enzym is ook een structureel eiwit en een van de hoofdbestanddelen van de celkernmatrix tijdens interfase..
Soorten topoisomerasen
Er zijn twee hoofdtypen topoisomerasen, afhankelijk van of ze een of twee strengen DNA kunnen splitsen.
-Type I topoisomerasen
Monomeer
Type I topoisomerasen zijn monomeren die negatieve en positieve supercoils verlichten, die worden geproduceerd door haarspeldbeweging tijdens transcriptie en tijdens genreplicatie- en recombinatieprocessen..
Type I topoisomerasen kunnen worden onderverdeeld in type 1A en type 1B. De laatste zijn die gevonden bij mensen, en zijn verantwoordelijk voor het ontspannen van supercoiled DNA.
Tyrosine op zijn actieve site
Topoisomerase 1B (Top1B) bestaat uit 765 aminozuren verdeeld over 4 specifieke domeinen. Een van deze domeinen heeft een sterk geconserveerd gebied met de actieve tyrosine-plaats (Tyr7233). Alle topoisomerasen presenteren op hun actieve plaats een tyrosine met een fundamentele rol in het gehele katalytische proces.
Werkingsmechanisme
De actieve plaats tyrosine vormt een covalente binding met het 3'-fosfaatuiteinde van de DNA-streng, snijdt het af en houdt het gehecht aan het enzym, terwijl een andere DNA-streng door de splitsing wordt geleid..
De passage van de andere DNA-streng door de gespleten streng wordt bereikt dankzij een conformationele transformatie van het enzym, die de opening van de dubbele DNA-helix produceert..
Dan keert topoisomerase I terug naar zijn oorspronkelijke conformatie en bindt de gespleten uiteinden weer. Dit gebeurt door een proces dat omgekeerd is aan de afbraak van de DNA-keten, op de katalytische plaats van het enzym. Ten slotte geeft topoisomerase de DNA-streng vrij.
De snelheid van DNA-ligatie is hoger dan de snelheid van excisie, waardoor de stabiliteit van het molecuul en de integriteit van het genoom worden gegarandeerd..
Samenvattend katalyseert type I topoisomerase:
- De splitsing van een streng.
- De passage van de andere streng door het decolleté.
- Ligatie van de gespleten uiteinden.
-Type II topoisomerasen
Dimeer
Type II topoisomerasen zijn dimere enzymen, die beide DNA-strengen splitsen, waardoor de supercoils die worden gegenereerd tijdens transcriptie en andere cellulaire processen ontspannen.
Mg afhankelijk++ en ATP
Deze enzymen hebben magnesium (Mg++) en hebben ook de energie nodig die afkomstig is van de afbraak van de ATP-trifosfaatbinding, waarvan ze profiteren dankzij een ATPase.
Twee actieve sites met tyrosine
Menselijke topoisomerasen II lijken sterk op die van gist (Saccharomyces cerevisiae), die is opgebouwd uit twee monomeren (subfragmenten A en B). Elk monomeer heeft een ATPase-domein en in een subfragment de actieve plaats tyrosine 782, waaraan DNA kan binden. Zo kunnen twee strengen DNA binden aan topoisomerase II..
Werkingsmechanisme
Het werkingsmechanisme van topoisomerase II is hetzelfde als dat beschreven voor topoisomerase I, aangezien twee DNA-strengen gesplitst zijn en niet slechts één..
Op de actieve plaats van topoisomerase II, een fragment van dubbele helix van DNA, genaamd "fragment G". Dit fragment wordt uitgesneden en bij elkaar gehouden op de actieve plaats door covalente bindingen..
Vervolgens laat het enzym een ander DNA-fragment, genaamd "T-fragment", door het gesplitste fragment "G" gaan, dankzij een conformationele verandering van het enzym, dat afhankelijk is van de hydrolyse van ATP..
Topoisomerase II bindt de twee uiteinden van het "G-fragment" en herstelt tenslotte zijn oorspronkelijke toestand, waarbij het "G" -fragment vrijkomt. Het DNA ontspant vervolgens de torsiespanning, waardoor de replicatie- en transcriptieprocessen kunnen plaatsvinden..
-Menselijke topoisomerasen
Het menselijk genoom heeft vijf topoisomerasen: top1, top3α, top3β (van type I); en top2α, top2β (van type II). De meest relevante menselijke topoisomerasen zijn top1 (type IB topoisomerase) en 2α (type II topoisomerase).
Topoisomerase-remmers
-Topoisomerasen als doelwit voor chemische aantasting
Omdat de door topoisomerasen gekatalyseerde processen nodig zijn voor het overleven van cellen, zijn deze enzymen een goed doelwit van aanvallen om kwaadaardige cellen te beïnvloeden. Om deze reden worden topoisomerasen als belangrijk beschouwd bij de behandeling van vele ziekten bij de mens..
Geneesmiddelen die een interactie aangaan met topoisomerasen worden momenteel uitgebreid bestudeerd als chemotherapeutische stoffen tegen kankercellen (in verschillende organen van het lichaam) en pathogene micro-organismen..
-Soorten remming
Geneesmiddelen die de topoisomerase-activiteit remmen, kunnen:
- Ingeklemd in DNA.
- Beïnvloed het enzym topoisomerase.
- Intercaleer in een molecuul dichtbij de actieve plaats van het enzym terwijl het DNA-topoisomerase-complex wordt gestabiliseerd.
Stabilisatie van het tijdelijke complex dat wordt gevormd door de binding van DNA aan de tyrosine van de katalytische plaats van het enzym, voorkomt de binding van de gespleten fragmenten, wat kan leiden tot celdood.
-Topoisomerase-remmers
Verbindingen die topoisomerasen remmen, zijn onder meer de volgende.
Antitumorantibiotica
Antibiotica worden gebruikt tegen kanker, omdat ze de groei van tumorcellen voorkomen, meestal door hun DNA te verstoren. Deze worden vaak antineoplastische (kanker) antibiotica genoemd. Actinomycine D beïnvloedt bijvoorbeeld topoisomerase II en wordt gebruikt bij Wilms-tumoren bij kinderen en bij rabdomyosarcomen..
Anthracyclines
Antracyclines behoren tot de antibiotica, een van de meest effectieve middelen tegen kanker en met het breedste spectrum. Ze worden gebruikt voor de behandeling van longkanker, eierstokken, baarmoeder, maag, blaas, borst, leukemie en lymfomen. Het is bekend dat het topoisomerase II beïnvloedt door intercalatie in DNA.
De eerste anthracycline geïsoleerd uit een actinobacterie (Streptomyces peucetius) was daunorubicine. Later werd doxorubicine in het laboratorium gesynthetiseerd en momenteel worden ook epirubicine en idarubicine gebruikt.
Anthrachinonen
Anthrachinonen of anthraceendionen zijn van antraceen afgeleide verbindingen, vergelijkbaar met anthracyclines, die de topoisomerase II-activiteit beïnvloeden door intercalatie in DNA. Ze worden gebruikt voor uitgezaaide borstkanker, non-Hodgkin-lymfoom (NHL) en leukemie..
Deze medicijnen werden aangetroffen in de pigmenten van sommige insecten, planten (frangula, senna, rabarber), korstmossen en schimmels; evenals hoeliet, een natuurlijk mineraal. Afhankelijk van uw dosis kunnen ze kankerverwekkend zijn.
Onder deze verbindingen hebben we mitoxantron en zijn analoog, losoxantron. Deze voorkomen de proliferatie van kwaadaardige tumorcellen, die onomkeerbaar aan het DNA binden.
Epidofyllotoxinen
Podofyllotoxinen, zoals epidofyllotoxinen (VP-16) en teniposide (VM-26), vormen een complex met topoisomerase II. Ze worden onder andere gebruikt tegen longkanker, testikel, leukemie, lymfomen, eierstokkanker, borstcarcinoom en kwaadaardige intracraniële tumoren. Ze zijn geïsoleerd van planten Podophyllum notatum Y P. peltatum.
Camptothecin-analogen
Campothecines zijn verbindingen die topoisomerase I remmen, waaronder irinotecan, topotecan en diflomotecan..
Deze verbindingen zijn gebruikt tegen karteldarm-, long- en borstkanker en worden op natuurlijke wijze verkregen uit de schors en bladeren van de boomsoort. Camptotheca acuminata van de Chinese hoornvliesontwerpen en Tibet.
Natuurlijke remming
Structurele veranderingen van topoisomerasen I en II kunnen ook volledig natuurlijk voorkomen. Dit kan gebeuren tijdens sommige gebeurtenissen die uw katalytische proces beïnvloeden.
Deze veranderingen omvatten de vorming van pyrimidine-dimeren, verkeerde combinaties van stikstofbasen en andere gebeurtenissen die worden veroorzaakt door oxidatieve stress..
Referenties
- Anderson, H., en Roberge, M. (1992). DNA topoisomerase II: een overzicht van zijn betrokkenheid bij chromosoomstructuur, DNA-replicatie, transcriptie en mitose. Cell Biology International Reports, 16 (8): 717-724. doi: 10.1016 / s0309-1651 (05) 80016-5
- Chhatriwala, H., Jafri, N., en Salgia, R. (2006). Een overzicht van de remming van topoisomerase bij longkanker. Kankerbiologie en therapie, 5 (12): 1600-1607. doi: 10.4161 / cbt.5.12.3546
- Ho, Y.-P., Au-Yeung, S. C. F., & To, K. K. W. (2003). Op platina gebaseerde antikankermiddelen: innovatieve ontwerpstrategieën en biologische perspectieven. Medicinal Research Reviews, 23 (5): 633-655. doi: 10.1002 / med.10038
- Li, T.-K., en Liu, L. F. (2001). Tumorceldood geïnduceerd door topoisomerase-gerichte geneesmiddelen. Jaaroverzicht van farmacologie en toxicologie, 41 (1): 53-77. doi: 10.1146 / annurev.pharmtox.41.1.53
- Liu, L. F. (1994). DNA-topoisomerasen: op topoisomerase gerichte geneesmiddelen. Academische pers. blz 307
- Osheroff, N. en Bjornsti, M. (2001). DNA Topoisomerase. Enzymologie en medicijnen. Vol.II. Humana Press. blz 329.
- Rothenberg, M. L. (1997). Topoisomerase I-remmers: herziening en update. Annals of Oncology, 8 (9), 837-855. doi: 10.1023 / een: 1008270717294
- Ryan B. (2009, 14 december). Topoisomerase 1 en 2. [Videobestand]. Opgehaald van youtube.com



Niemand heeft nog op dit artikel gereageerd.