
Wolfraamgeschiedenis, eigenschappen, structuur, gebruik
De wolfraam, wolfraam of wolfraam is een zwaar overgangsmetaal waarvan het chemische symbool W. is. Het bevindt zich in periode 6 met groep 6 van het periodiek systeem, en het atoomnummer is 74. De naam heeft twee etymologische betekenissen: hardsteen en wolfsschuim; van de tweede is omdat dit metaal ook bekend staat als wolfraam.
Het is een zilvergrijs metaal en hoewel het bros is, heeft het een grote hardheid, dichtheid en hoge smelt- en kookpunten. Daarom is het gebruikt in al die toepassingen waarbij hoge temperaturen, drukken of mechanische krachten betrokken zijn, zoals boren, projectielen of stralingsemitterende filamenten..

Het bekendste gebruik voor dit metaal, op cultureel en populair niveau, is in de gloeidraden van elektrische gloeilampen. Degene die ze heeft gemanipuleerd, zal beseffen hoe kwetsbaar ze zijn; ze zijn echter niet gemaakt van zuiver wolfraam, dat vervormbaar en taai is. Bovendien biedt het in metallische matrices zoals legeringen uitstekende weerstand en hardheid.
Het wordt gekenmerkt en onderscheidt zich doordat het het metaal is met het hoogste smeltpunt, en ook doordat het dichter is dan lood zelf, alleen overtroffen door andere metalen zoals osmium en iridium. Het is ook het zwaarste metaal waarvan bekend is dat het een biologische rol in het lichaam speelt..
Het wolframaatanion, WO4twee-, die kunnen polymeriseren om clusters te vormen in een zuur medium. Aan de andere kant kan wolfraam intermetallische verbindingen vormen, of worden gesinterd met metalen of anorganische zouten, zodat de vaste stoffen verschillende vormen of consistenties krijgen..
Het is niet erg overvloedig in de aardkorst, met slechts 1,5 gram van dit metaal per ton. Bovendien, aangezien het een zwaar element is, is zijn oorsprong intergalactisch; specifiek van supernova-explosies, die tijdens de vorming 'stralen' van wolfraamatomen naar onze planeet moeten hebben geworpen.
Artikel index
- 1 Geschiedenis
- 1.1 Etymologie
- 1.2 Erkenning en ontdekking
- 1.3 Staalsoorten en bollen
- 2 Eigenschappen
- 2.1 Fysiek uiterlijk
- 2.2 Atoomnummer
- 2.3 Molaire massa
- 2.4 Smeltpunt
- 2.5 Kookpunt
- 2.6 Dichtheid
- 2.7 Warmte van fusie
- 2.8 Verdampingswarmte
- 2,9 Molaire warmtecapaciteit
- 2.10 Moh's hardheid
- 2.11 Elektronegativiteit
- 2.12 Atoomradius
- 2.13 Elektrische weerstand
- 2.14 Isotopen
- 2.15 Chemie
- 2.16 Zuurclustering
- 3 Structuur en elektronische configuratie
- 3.1 Kristallijne fasen
- 3.2 Metaalbinding
- 3.3 oxidatietoestanden
- 4 Verkrijgen
- 5 toepassingen
- 6 Risico's en voorzorgsmaatregelen
- 6.1 Biologicals
- 6.2 Fysiek
- 7 referenties
Verhaal
Etymologie
De geschiedenis van wolfraam of wolfraam heeft twee gezichten, net als hun namen: de ene Zwitser en de andere Duitser. In de 17e eeuw werkten mijnwerkers in regio's die momenteel worden bezet door Duitsland en Oostenrijk bij de winning van koper en tin om bronzen beelden te produceren.
Tegen die tijd zaten de mijnwerkers met een doorn in het proces: er was een buitengewoon moeilijk mineraal om te smelten; mineraal bestaande uit wolframiet, (Fe, Mn, Mg) WO4, die het blik vasthielden of "verslonden" alsof het een wolf was.
Vandaar de etymologie voor dit element, 'wolf' voor wolf in het Spaans, een wolf die tin at; en 'ram' van schuim of crème, waarvan de kristallen leken op een lange zwarte vacht. Zo ontstond ter ere van deze eerste waarnemingen de naam 'wolfram' of 'wolfram'.
In 1758, aan Zwitserse zijde, een soortgelijk mineraal, scheeliet, CaWO4, het heette 'tung sten', wat 'harde steen' betekent.
Beide namen, wolfraam en wolfraam, worden veel door elkaar gebruikt, alleen afhankelijk van de cultuur. In Spanje bijvoorbeeld en in West-Europa staat dit metaal vooral bekend als wolfraam; terwijl op het Amerikaanse continent de naam wolfraam overheerst.
Erkenning en ontdekking
Het was toen bekend dat er tussen de zeventiende en achttiende eeuw twee mineralen waren: wolframiet en scheeliet. Maar wie zag dat er een ander metaal in zat dan de anderen? Ze konden alleen als mineralen worden gekarakteriseerd, en het was in 1779 dat de Ierse chemicus Peter Woulfe zorgvuldig wolfraam analyseerde en het bestaan van wolfraam afleidde..
Aan de Zwitserse kant kon Carl Wilhelm Scheele in 1781 opnieuw wolfraam isoleren als WO3en zelfs meer, hij verkreeg wolfraamzuur (of wolfraamzuur), HtweeWO4 en andere verbindingen.
Dit was echter niet voldoende om bij het zuivere metaal te komen, aangezien het nodig was om dit zuur te verminderen; dat wil zeggen, het onderwerpen aan een zodanig proces dat het loskomt van zuurstof en kristalliseert als metaal. Carl Wilhelm Scheele beschikte niet over de geschikte ovens of methodologie voor deze chemische reductiereactie.
Hier kwamen in de stad Bergara de Spaanse broers d'Elhuyar, Fausto en Juan José in actie, die beide mineralen (wolframiet en scheeliet) met steenkool reduceerden. Beiden krijgen de verdienste en eer om de ontdekkers te zijn van metallic wolfram of wolfraam (W).
Staalsoorten en bollen

Net als andere metalen, bepaalt het gebruik zijn geschiedenis. Tot de meest prominente aan het einde van de 19e eeuw behoorden staal-wolfraamlegeringen en wolfraamgloeidraden om koolstof in elektrische gloeilampen te vervangen. Men kan zeggen dat de eerste gloeilampen, zoals we die kennen, in 1903-1904 op de markt kwamen.
Eigendommen
Fysiek uiterlijk
Het is een glanzend zilvergrijs metaal. Breekbaar maar erg moeilijk (niet te verwarren met taaiheid). Als het stuk van hoge zuiverheid is, wordt het vervormbaar en hard, evenveel of meer als verschillende staalsoorten.
Atoomnummer
74.
Molaire massa
183,85 g / mol.
Smeltpunt
3422 ° C.
Kookpunt
5930ºC.
Dichtheid
19,3 g / ml.
Warmte van fusie
52,31 kJ / mol.
Warmte van verdamping
774 kJ / mol.
Molaire warmtecapaciteit
24,27 kJ / mol.
Moh's hardheid
7.5.
Elektronegativiteit
2,36 op de schaal van Pauling.
Atomaire radio
139 uur
Elektrische weerstand
52,8 nΩ · m bij 20ºC.
Isotopen
Het komt voornamelijk in de natuur voor als vijf isotopen: 182W., 183W., 184W., 186W en 180W.Volgens de molaire massa van 183 g / mol, wat het gemiddelde is van de atoommassa's van deze isotopen (en de overige dertig radio-isotopen), heeft elk wolfraam- of wolfraamatoom ongeveer honderdtien neutronen (74 + 110 = 184).
Chemie
Het is een metaal dat zeer goed bestand is tegen corrosie, aangezien het een dunne laag WO is3 Het beschermt het tegen de aantasting van zuurstof, zuur en logen. Eenmaal opgelost en neergeslagen met andere reagentia, worden de zouten ervan verkregen, die wolframaten of wolframaten worden genoemd; daarin heeft wolfraam meestal een oxidatietoestand van +6 (ervan uitgaande dat er kationen W zijn6+.
Zure clustering
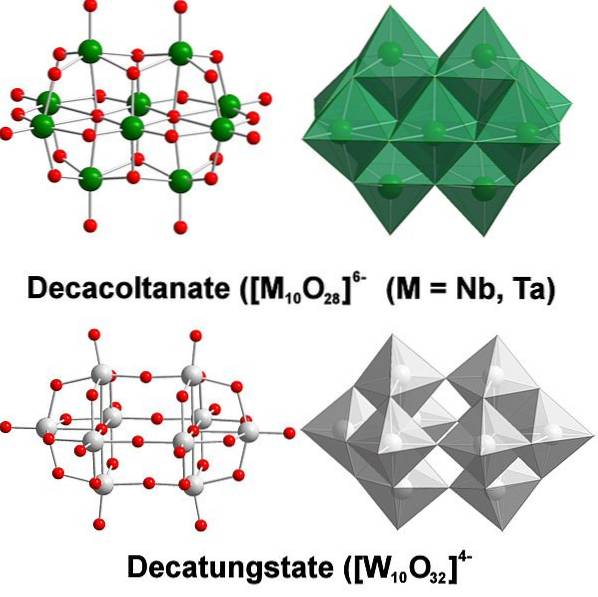
Chemisch gezien is wolfraam vrij bijzonder omdat zijn ionen de neiging hebben om te clusteren om heteropolyzuren of polyoxometalaten te vormen. Wat zijn zij? Het zijn groepen of clusters van atomen die samenkomen om een driedimensionaal lichaam te definiëren; Voornamelijk een met een bolvormige kooiachtige structuur, waarin ze een ander atoom "omsluiten".
Het begint allemaal met het wolframaatanion, WO4twee-, die in zuur medium snel protoneert (HWO4-) en bindt zich met een naburig anion om [WtweeOF7(OH)tweetwee-en dit voegt zich op zijn beurt weer bij een andere [WtweeOF7(OH)tweetwee- om de [W4OF12(OH)44-. Dus door totdat er verschillende politungstats in oplossing zijn.
Parawolframen A en B, [W7OF246- en HtweeW.12OF4210-, respectievelijk zijn ze een van de meest opvallende van deze polyanionen.
Het kan een uitdaging zijn om met uw Lewis-contouren en structuren te komen; maar het is in principe voldoende om ze te visualiseren als sets WO octaëders6 (bovenste afbeelding).
Merk op dat deze grijsachtige octaëders uiteindelijk de decawolfstaat, een politungstaat; als het een heteroatoom (bijvoorbeeld fosfor) bevat, zou het een polyoxometalaat zijn.
Structuur en elektronische configuratie
Kristallijne fasen
Wolfraamatomen definiëren een kristal met een op het lichaam gecentreerde kubische structuur (bcc, voor lichaamsgerichte kubiekDeze kristallijne vorm staat bekend als de α-fase; terwijl de β-fase ook kubisch is, maar iets dichter. Beide fasen of kristallijne vormen, α en β, kunnen onder normale omstandigheden in evenwicht naast elkaar bestaan.
De kristallijne korrels van de α-fase zijn isometrisch, terwijl die van de β-fase lijken op kolommen. Ongeacht hoe het kristal is, het wordt beheerst door de metaalverbindingen die de W-atomen stevig bij elkaar houden.Anders zouden de hoge smelt- en kookpunten of de hoge hardheid en dichtheid van wolfraam niet kunnen worden verklaard..
Metalen binding
Wolfraamatomen moeten op de een of andere manier stevig worden verbonden. Om een vermoeden te doen, moet eerst de elektronenconfiguratie van dit metaal worden waargenomen:
[Xe] 4f145 d46stwee
De 5d-orbitalen zijn erg groot en wazig, wat zou betekenen dat er tussen twee nabijgelegen W-atomen effectieve orbitale overlappingen zijn. Evenzo dragen de 6s-orbitalen bij aan de resulterende banden, maar in mindere mate. Terwijl de 4f-orbitalen "diep op de achtergrond" zijn en daarom minder bijdragen aan de metaalbinding.
Dit, de grootte van de atomen en de kristallijne korrels, zijn de variabelen die de hardheid van wolfraam en zijn dichtheid bepalen..
Oxidatietoestanden
In wolfraam of metallisch wolfram hebben de W-atomen een oxidatietoestand nul (W.0Terugkerend naar de elektronische configuratie, kunnen de 5d- en 6s-orbitalen worden "leeggemaakt" van elektronen, afhankelijk van of W in het gezelschap is van sterk elektronegatieve atomen, zoals zuurstof of fluor..
Wanneer de twee 6s-elektronen verloren gaan, heeft wolfraam een oxidatietoestand +2 (W.twee+), waardoor zijn atoom samentrekt.
Als het ook alle elektronen in zijn 5d-orbitalen verliest, wordt zijn oxidatietoestand +6 (W.6+Vanaf hier kan het (in theorie) niet positiever worden, aangezien de 4f-orbitalen, omdat ze intern zijn, grote energieën nodig zouden hebben om hun elektronen te verwijderen. Dat wil zeggen, de meest positieve oxidatietoestand is +6, waar het wolfraam nog kleiner is.
Dit wolfraam (VI) is zeer stabiel in zure omstandigheden of in veel geoxygeneerde of gehalogeneerde verbindingen. Andere mogelijke en positieve oxidatietoestanden zijn: +1, +2, +3, +4, +5 en +6.
Wolfraam kan ook elektronen winnen als het combineert met atomen die minder elektronegatief zijn dan het. In dit geval worden de atomen groter. Het kan maximaal vier elektronen winnen; dat wil zeggen, een oxidatietoestand hebben van -4 (W.4-.
Het verkrijgen van
Eerder werd vermeld dat wolfraam wordt aangetroffen in de mineralen wolframiet en scheeliet. Afhankelijk van het proces worden daaruit twee verbindingen verkregen: wolfraamoxide, WO3, of ammoniumparawolframaat, (NH410(H.tweeW.12OF42) · 4HtweeO (of ATP). Elk van hen kan worden teruggebracht tot metallisch W met koolstof boven 1050 ° C.
Het is economisch niet rendabel om wolfraamstaven te produceren, omdat ze veel warmte (en geld) nodig hebben om ze te smelten. Daarom heeft het de voorkeur om het in poedervorm te produceren om het in één keer met andere metalen te behandelen om legeringen te verkrijgen..
Het is vermeldenswaard dat China het land is met de grootste wolfraamproductie ter wereld. En op het Amerikaanse continent, Canada, Bolivia en Brazilië bezetten ze ook de lijst van de grootste producenten van dit metaal.
Toepassingen

Hier zijn enkele van de bekende toepassingen voor dit metaal:
-De zouten ervan werden gebruikt om katoen van oude theaterkleding te kleuren.
-In combinatie met staal wordt het nog harder, zodat het zelfs bij hoge snelheden mechanische sneden kan weerstaan.
-Gesinterde wolfraamgloeidraden worden al meer dan honderd jaar gebruikt in elektrische gloeilampen en halogeenlampen. Vanwege zijn hoge smeltpunt heeft het ook gediend als materiaal voor kathodestraalbuizen en voor de straalpijpen van raketmotoren..
-Vervangt lood bij de vervaardiging van projectielen en radioactieve schilden.
-Wolfraam-nanodraden kunnen worden gebruikt in pH- en gasgevoelige nanodraden.
-Wolfraamkatalysatoren werden gebruikt om de zwavelproductie in de olie-industrie aan te pakken.
-Wolfraamcarbide is de meest gebruikte van al zijn verbindingen. Van het versterken van snij- en boorgereedschap, of het vervaardigen van militaire bewapening, tot het bewerken van hout, plastic en keramiek.
Risico's en voorzorgsmaatregelen
Biologisch
Omdat het een relatief zeldzaam metaal is in de aardkorst, zijn de negatieve effecten ervan schaars. In zure bodems hebben polywolframaten mogelijk geen invloed op de enzymen die molybdaatanionen gebruiken; maar in basisbodems, de WO4twee- grijpt wel (positief of negatief) in in de stofwisselingsprocessen van MoO4twee- en koper.
Planten kunnen bijvoorbeeld oplosbare wolfraamverbindingen opnemen, en wanneer een dier ze eet en vervolgens nadat ze zijn vlees hebben gegeten, komen W-atomen ons lichaam binnen. De meeste worden via de urine en uitwerpselen uitgescheiden en er is weinig bekend wat er met de rest gebeurt..
Studies bij dieren hebben aangetoond dat wanneer ze hoge concentraties wolfraampoeder inademen, ze symptomen ontwikkelen die vergelijkbaar zijn met die van longkanker.
Door inslikken zou een volwassen mens duizenden liters water verrijkt met wolfraamzouten moeten drinken om een merkbare remming van de enzymen cholinesterase en fosfatase te vertonen..
Fysiek
In het algemeen is wolfraam een laag toxisch element en daarom zijn er weinig milieurisico's voor gezondheidsschade..
Vermijd met betrekking tot metallisch wolfraam het inademen van het stof; en als het monster stevig is, moet u er rekening mee houden dat het zeer dicht is en dat het fysieke schade kan veroorzaken als het valt of andere oppervlakken raakt.
Referenties
- Bell Terence. (s.f.). Wolfraam (Wolfram): eigenschappen, productie, toepassingen en legeringen. De balans. Hersteld van: thebalance.com
- Wikipedia. (2019). Wolfraam. Hersteld van: en.wikipedia.org
- Lenntech B.V. (2019). Wolfraam. Hersteld van: lenntech.com
- Jeff Desjardins. (1 mei 2017). De geschiedenis van wolfraam, het sterkste natuurlijke metaal op aarde. Hersteld van: visualcapitalist.com
- Doug Stewart. (2019). Feiten over wolfraamelementen. Hersteld van: chemicool.com
- Art Fisher en Pam Powell. (s.f.). Wolfraam. Universiteit van Nevada. Hersteld van: unce.unr.edu
- Helmenstine, Anne Marie, Ph.D. (02 maart 2019). Feiten over wolfraam of wolfram. Hersteld van: thoughtco.com


Niemand heeft nog op dit artikel gereageerd.