
Stikstof valentieconfiguratie en verbindingen

De stikstofvalenties Ze variëren van -3, zoals in ammoniak en aminen, tot +5 zoals in salpeterzuur (Tyagi, 2009). Dit element breidt valenties niet uit zoals andere.
Het stikstofatoom is een chemisch element met atoomnummer 7 en het eerste element van groep 15 (voorheen VA) van het periodiek systeem. De groep bestaat uit stikstof (N), fosfor (P), arseen (As), antimoon (Sb), bismut (Bi) en moscovium (Mc).

De elementen delen bepaalde algemene overeenkomsten in chemisch gedrag, hoewel ze chemisch duidelijk van elkaar verschillen. Deze overeenkomsten weerspiegelen gemeenschappelijke kenmerken van de elektronische structuren van hun atomen (Sanderson, 2016).
Stikstof is in bijna alle eiwitten aanwezig en speelt een belangrijke rol in zowel biochemische als industriële toepassingen. Stikstof vormt sterke bindingen vanwege het vermogen om een drievoudige binding te vormen met een ander stikstofatoom en andere elementen..
Daarom zit er een grote hoeveelheid energie in stikstofverbindingen. Vóór 100 jaar geleden was er weinig bekend over stikstof. Nu wordt stikstof vaak gebruikt om voedsel te bewaren en als meststof (Wandell, 2016).
Elektronische configuratie en valenties
In een atoom vullen de elektronen de verschillende niveaus op basis van hun energieën. De eerste elektronen vullen de lagere energieniveaus en gaan dan naar een hoger energieniveau.
Het buitenste energieniveau in een atoom staat bekend als de valentieschil en de elektronen die in deze schaal zijn geplaatst, staan bekend als valentie-elektronen..
Deze elektronen worden voornamelijk aangetroffen bij de vorming van bindingen en chemische reactie met andere atomen. Daarom zijn valentie-elektronen verantwoordelijk voor verschillende chemische en fysische eigenschappen van een element (Valence Electrons, S.F.).
Stikstof heeft, zoals eerder vermeld, een atoomnummer van Z = 7. Dit impliceert dat de vulling van elektronen in hun energieniveaus, of elektronenconfiguratie, 1S istwee 2Stwee 2 Blz3.
Er moet aan worden herinnerd dat atomen in de natuur altijd de elektronische configuratie van edelgassen proberen te hebben, hetzij door elektronen te winnen, te verliezen of te delen..
In het geval van stikstof is neon het edelgas dat naar een elektronische configuratie streeft, waarvan het atoomnummer Z = 10 (1Stwee 2Stwee 2 Blz6) en helium, waarvan het atoomnummer Z = 2 (1Stwee) (Reusch, 2013).
De verschillende manieren waarop stikstof moet worden gecombineerd, geven het zijn valentie (of oxidatietoestand). In het specifieke geval van stikstof, omdat het zich in de tweede periode van het periodiek systeem bevindt, kan het zijn valentieschil niet uitbreiden zoals de andere elementen van zijn groep dat doen..
Er wordt verwacht dat het valenties heeft van -3, +3 en +5. Stikstof heeft echter valentie-toestanden die variëren van -3, zoals in ammoniak en aminen, tot +5, zoals in salpeterzuur. (Tyagi, 2009).
De valentiebindingstheorie helpt de vorming van verbindingen te verklaren, volgens de elektronenconfiguratie van stikstof voor een gegeven oxidatietoestand. Hiervoor is het noodzakelijk om rekening te houden met het aantal elektronen in de valentieschil en hoeveel er nog over is om de edelgasconfiguratie te verkrijgen..
Stikstofverbindingen
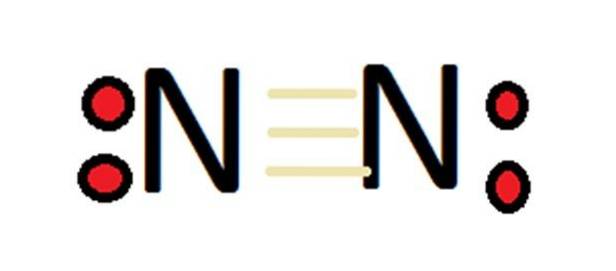
Gezien het grote aantal oxidatietoestanden kan stikstof een groot aantal verbindingen vormen. In eerste instantie moet eraan worden herinnerd dat in het geval van moleculaire stikstof de valentie per definitie 0 is.
De oxidatietoestand van -3 is een van de meest voorkomende voor het element. Voorbeelden van verbindingen met deze oxidatietoestand zijn ammoniak (NH3), aminen (R3N), ammoniumion (NH4+), iminen (C = N-R) en nitrilen (C≡N).
In de oxidatietoestand -2 blijft stikstof achter met 7 elektronen in zijn valentieschil. Dit oneven aantal elektronen in de valentieschil verklaart waarom verbindingen met deze oxidatietoestand een overbruggende binding hebben tussen twee stikstofatomen. Voorbeelden van verbindingen met deze oxidatietoestand zijn hydrazines (R.twee-N-N-Rtwee) en hydrazonen (C = N-N-Rtwee.
In de -1 oxidatietoestand blijft stikstof achter met 6 elektronen in de valentieschil. Voorbeeld van stikstofverbindingen met deze valentie zijn hydroxylamine (R.tweeNOH) en de azoverbindingen (RN = NR).
In positieve oxidatietoestanden wordt stikstof over het algemeen aan zuurstofatomen gehecht om oxiden, oxyszouten of oxzuren te vormen. In het geval van de +1 oxidatietoestand heeft stikstof 4 elektronen in zijn valentieschil.
Voorbeelden van verbindingen met deze valentie zijn distikstofoxide of lachgas (N.tweeO) en nitrosoverbindingen (R = NO) (Reusch, Oxidation States of Nitrogen, 2015).
In het geval van de oxidatietoestand van +2 is een voorbeeld stikstofoxide of stikstofoxide (NO), een kleurloos gas dat wordt geproduceerd door de reactie van metalen met verdund salpeterzuur. Deze verbinding is een uiterst onstabiele vrije radicaal omdat het reageert met Otwee in de lucht om het NO-gas te vormentwee.
Nitriet (NOtwee-) in basische oplossing en salpeterig zuur (HNOtwee) in zure oplossing zijn voorbeelden van verbindingen met oxidatietoestand +3. Dit kunnen oxidatiemiddelen zijn om normaal NO (g) te produceren of reductiemiddelen om het nitraation te vormen..
Distikstoftrioxide (N.tweeOF3) en de nitrogroep (R-NOtwee) zijn andere voorbeelden van stikstofverbindingen met valentie +3.
Stikstofdioxide (NOtwee) of stikstofdioxide is een stikstofverbinding met valentie +4. Het is een bruin gas dat over het algemeen wordt geproduceerd door de reactie van geconcentreerd salpeterzuur met veel metalen. Dimeriseert om N te vormentweeOF4.
In de +5-toestand vinden we nitraten en salpeterzuur, die oxidatiemiddelen zijn in zuuroplossingen. In dit geval heeft stikstof 2 elektronen in de valentieschil, die zich in de 2S-orbitaal bevinden. (Oxidatietoestanden van stikstof, S.F.).
Er zijn ook verbindingen zoals nitrosilazide en distikstoftrioxide waarbij stikstof verschillende oxidatietoestanden in het molecuul heeft. In het geval van nitrosilazide (N.4O) stikstof heeft een valentie van -1, 0, + 1 en +2; en in het geval van distikstoftrioxide heeft het valentie +2 en +4.
Nomenclatuur van stikstofverbindingen
Gezien de complexiteit van de chemie van stikstofverbindingen, was de traditionele nomenclatuur niet voldoende om ze te benoemen, laat staan ze correct te identificeren. Dat is onder meer de reden waarom de International Union of Pure and Applied Chemistry (IUPAC) een systematische nomenclatuur heeft opgesteld waarin verbindingen worden genoemd naar het aantal atomen dat ze bevatten..
Dit is gunstig als het gaat om het benoemen van stikstofoxiden. Stikstofmonoxide wordt bijvoorbeeld stikstofmonoxide genoemd en distikstofoxide (NO) distikstofmonoxide (N.tweeOF).
Bovendien ontwikkelde de Duitse chemicus Alfred Stock in 1919 een methode voor het benoemen van chemische verbindingen op basis van de oxidatietoestand, die is geschreven in Romeinse cijfers tussen haakjes. Zo zouden bijvoorbeeld stikstofoxide en lachgas respectievelijk stikstofoxide (II) en stikstofoxide (I) worden genoemd (IUPAC, 2005).
Referenties
- (2005). NOMENCLATUUR VAN ANORGANISCHE CHEMIE IUPAC-aanbevelingen 2005. Opgehaald van iupac.org.
- Oxidatietoestanden van stikstof. (S.F.). Hersteld van kpu.ca.
- Reusch, W. (2013, 5 mei). Elektronenconfiguraties in het periodiek systeem. Opgehaald van chemistry.msu.edu.
- Reusch, W. (2015, 8 augustus). Oxidatietoestanden van stikstof. Opgehaald van chem.libretexts.org.
- Sanderson, R. T. (2016, 12 december). Stikstofgroepelement. Opgehaald van britannica.com.
- Tyagi, V. P. (2009). Essentiële chemie XII. Nieuwe Deli: Ratna Sagar.
- Valentie-elektronen. (S.F.). Opgehaald van chemistry.tutorvista.com.
- Wandell, A. (2016, 13 december). Chemie van stikstof. Opgehaald van chem.libretexts.org.



Niemand heeft nog op dit artikel gereageerd.