
Voltammetrie waaruit het bestaat, soorten en toepassingen
De voltammetrie Het is een elektroanalytische techniek die informatie van een chemische soort of analyt bepaalt uit de elektrische stromen die worden gegenereerd door de variatie van een aangelegd potentiaal. Dat wil zeggen, de toegepaste potentiaal E (V) en de tijd (t) zijn de onafhankelijke variabelen; terwijl de stroom (A), de afhankelijke variabele.
De chemische soort moet gewoonlijk elektroactief zijn. Wat betekent het? Het betekent dat het elektronen moet verliezen (oxideren) of winnen (verminderen). Om de reactie te starten, moet de werkelektrode het noodzakelijke potentieel leveren dat theoretisch bepaald wordt door de Nernst-vergelijking.
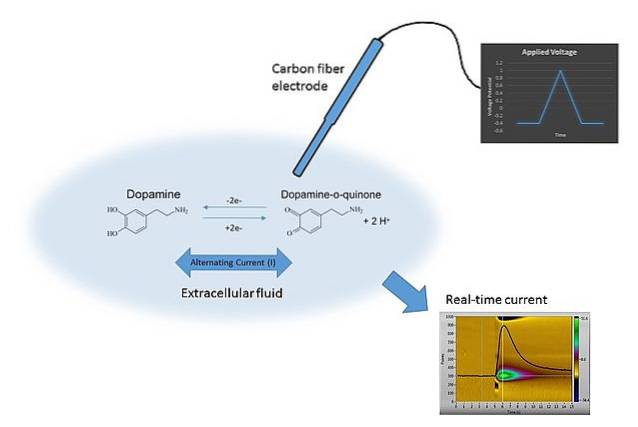
Een voorbeeld van voltammetrie is te zien in de bovenstaande afbeelding. De elektrode in de afbeelding is gemaakt van koolstofvezels, die is ondergedompeld in het oplossingsmedium. Dopamine oxideert niet en vormt twee carbonylgroepen C = O (rechterkant van de chemische vergelijking) tenzij het juiste potentieel wordt toegepast.
Dit wordt bereikt door E te scannen met verschillende waarden, beperkt door vele factoren, zoals de oplossing, de aanwezige ionen, dezelfde elektrode en dopamine..
Door E in de tijd te variëren, worden twee grafieken verkregen: de eerste E v t (de blauwe driehoek) en de tweede, de respons C vs t (geel). De vormen zijn kenmerkend voor het bepalen van dopamine onder de omstandigheden van het experiment..
Artikel index
- 1 Wat is voltammetrie??
- 1.1 Voltammetrische golf
- 1.2 Instrumentatie
- 2 soorten
- 2.1 Pulse voltammetrie
- 2.2 Heroplossingsvoltammetrie
- 3 Toepassingen
- 4 referenties
Wat is voltammetrie?
Voltammetrie werd ontwikkeld dankzij de uitvinding van de polarografietechniek door de Nobelprijswinnaar in de scheikunde uit 1922, Jaroslav Heyrovsky. Daarin wordt de elektrode van de kwikdruppel (EGM) constant vernieuwd en gepolariseerd.
De analytische tekortkomingen van deze methode op dat moment werden opgelost met het gebruik en ontwerp van andere micro-elektroden. Deze variëren enorm in materiaal, van koolstof, edelmetalen, diamant en polymeren, tot in hun ontwerp, schijven, cilinders, platen; en ook in de manier waarop ze omgaan met de oplossing: stationair of roterend.
Al deze details zijn bedoeld om de polarisatie van de elektrode te bevorderen, die een verval veroorzaakt van de geregistreerde stroom die bekend staat als limietstroom (i1Dit is evenredig met de concentratie van de analyt en de helft van de potentie E (E.1/2) om de helft van genoemde stroom (i1/2) is kenmerkend voor de soort.
Bepaal vervolgens de waarden van E1/2 op de curve waar de stroom verkregen met de variatie van E, genoemd voltamperogram, de aanwezigheid van een analyt kan worden geïdentificeerd. Dat wil zeggen dat elke analyt, gegeven de omstandigheden van het experiment, zijn eigen waarde van E zal hebben1/2.
Voltammetrische golf
Bij voltammetrie werk je met veel grafieken. De eerste is de E vs t-curve, die het mogelijk maakt om de toegepaste potentiaalverschillen op te volgen als functie van de tijd.
Maar tegelijkertijd registreert het elektrische circuit de C-waarden die door de analyt worden geproduceerd door elektronen te verliezen of te winnen in de buurt van de elektrode..
Omdat de elektrode gepolariseerd is, kan er minder analyt van binnenuit de oplossing erin diffunderen. Als de elektrode bijvoorbeeld positief is geladen, wordt de soort X- zal erdoor aangetrokken worden en zal er door louter elektrostatische aantrekking naartoe gaan.
Maar X- Je bent niet de enige: er zijn andere ionen in je omgeving aanwezig. Enkele kationen M+ ze kunnen de elektrode in de weg zitten door deze in "clusters" van positieve ladingen op te sluiten; en evenzo N anionen- kan vast komen te zitten rond de elektrode en X voorkomen- Ik heb hem te pakken.
De som van deze fysische verschijnselen zorgt ervoor dat stroom verloren gaat, en dit wordt waargenomen in de C vs E-curve en de vorm is vergelijkbaar met die van een S, de sigmoïde vorm genoemd. Deze curve staat bekend als een voltammetrische golf..
Instrumentatie
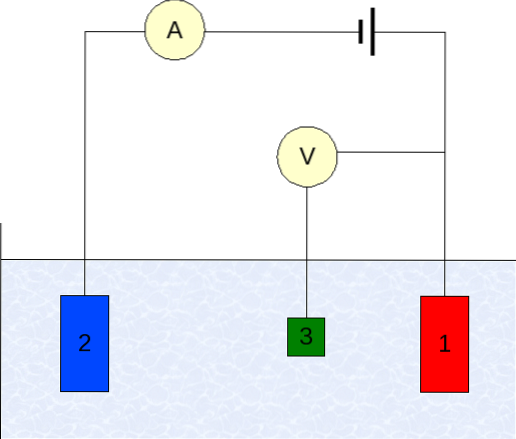
De instrumentatie van voltammetrie varieert afhankelijk van de analyt, het oplosmiddel, het type elektrode en de toepassing. Maar de overgrote meerderheid van hen is gebaseerd op een systeem dat bestaat uit drie elektroden: één voor werk (1), hulp (2) en de referentie (3)..
De belangrijkste gebruikte referentie-elektrode is de calomel-elektrode (ECS). Dit, samen met de werkelektrode, maakt het mogelijk om een potentiaalverschil ΔE vast te stellen, aangezien de potentiaal van de referentie-elektrode constant blijft tijdens metingen..
Aan de andere kant is de hulpelektrode verantwoordelijk voor het regelen van de lading die naar de werkelektrode gaat, om deze binnen aanvaardbare E-waarden te houden. De onafhankelijke variabele, het toegepaste potentiaalverschil, wordt verkregen door de potentialen van de werk- en referentie-elektroden bij elkaar op te tellen..
Types

De afbeelding hierboven toont een E vs t-grafiek, ook wel een potentiële golf genoemd voor een lineaire sweep-voltammetrie..
Het is duidelijk dat naarmate de tijd verstrijkt, het potentieel toeneemt. Deze sweep genereert op zijn beurt een responscurve of voltamperogram C vs E waarvan de vorm sigmoïde zal zijn. Er zal een punt komen waarop, ongeacht hoeveel E toeneemt, er geen toename in stroom zal zijn.
Andere soorten voltammetrie kunnen uit deze grafiek worden afgeleid. Hoe? Wijziging van de potentiële golf E vs t door middel van plotselinge potentiële pulsen volgens bepaalde patronen. Elk patroon wordt geassocieerd met een soort voltammetrie en omvat zijn eigen theorie en experimentele omstandigheden..
Pulse voltammetrie
Bij dit type voltammetrie kunnen mengsels van twee of meer analyten waarvan de E-waarden worden geanalyseerd1/2 zijn erg dicht bij elkaar. Dus een analyt met E.1/2 van 0,04V kan in het gezelschap van een ander worden geïdentificeerd met een E1/2 van 0,05V. Bij lineaire sweep-voltammetrie moet het verschil groter zijn dan 0,2 V..
Daarom zijn er hogere gevoeligheid en lagere detectielimieten; d.w.z. analyten kunnen bij zeer lage concentraties worden bepaald.
Potentiële golven kunnen patronen hebben die lijken op trappen, schuine trappen en driehoeken. Dit laatste komt overeen met cyclische voltammetrie (CV voor het acroniem in het Engels, eerste afbeelding).
In CV wordt een potentiaal E in één richting aangelegd, positief of negatief, en dan wordt bij een bepaalde waarde van E op tijdstip t dezelfde potentiaal opnieuw aangelegd, maar in de tegenovergestelde richting. Bij het bestuderen van de gegenereerde voltamperogrammen, onthullen de maxima de aanwezigheid van tussenpersonen in een chemische reactie.
Voltammetrie opnieuw oplossen
Dit kan van het anodische of kathodische type zijn. Het bestaat uit de elektrodepositie van de analyt op een kwikelektrode. Als de analyt een metaalion is (zoals Cdtwee+), vormt zich een amalgaam; en als het een anion is, (zoals MoO4twee-) een onoplosbaar kwikzout.
Vervolgens worden potentiaalpulsen toegepast om de concentratie en identiteit van de elektrodepositie-soort te bepalen. Het amalgaam wordt dus opnieuw opgelost, net als kwikzouten.
Toepassingen
-Anodische heroplossingsvoltammetrie wordt gebruikt om de concentratie van opgeloste metalen in vloeistof te bepalen.
-Het maakt het mogelijk de kinetiek van redox- of adsorptieprocessen te bestuderen, vooral wanneer de elektroden worden aangepast om een specifieke analyt te detecteren.
-De theoretische basis is gebruikt voor de vervaardiging van biosensoren. Hiermee kan de aanwezigheid en concentratie van biologische moleculen, eiwitten, vetten, suikers etc. worden bepaald..
-Ten slotte detecteert het de deelname van tussenpersonen aan de reactiemechanismen.
Referenties
- González M. (22 november 2010). Voltammetrie. Hersteld van: quimica.laguia2000.com
- Gómez-Biedma, S., Soria, E., & Vivó, M… (2002). Elektrochemische analyse. Journal of Biological Diagnosis, 51 (1), 18-27. Opgehaald van scielo.isciii.es
- Scheikunde en wetenschap. (18 juli 2011). Voltammetrie. Hersteld van: laquimicaylaciencia.blogspot.com
- Quiroga A. (16 februari 2017). Cyclische voltammetrie. Hersteld van: chem.libretexts.org
- Samuel P. Kounaves. (s.f.). Voltammetrische technieken. [Pdf]. Tufts University. Hersteld van: brown.edu
- Dag R. & Underwood A. Kwantitatieve analytische chemie (vijfde ed.). PEARSON Prentice Hall.



Niemand heeft nog op dit artikel gereageerd.