
Bariumoxide (BaO) structuur, eigenschappen, gebruik, risico's

De bariumoxide Het is een anorganische vaste stof gevormd door een bariumatoom (Ba) en een zuurstofatoom (O). De chemische formule is BaO. Het is een witte kristallijne vaste stof en is hygroscopisch, dat wil zeggen, het absorbeert vocht uit de lucht, maar reageert ermee..
De snelle reactie van bariumoxide met water zorgt ervoor dat het in laboratoria voor chemische analyse wordt gebruikt om uit te drogen, dat wil zeggen om water te verwijderen uit organische oplosmiddelen, dit zijn vloeibare verbindingen die dienen om andere stoffen op te lossen..

BaO gedraagt zich als een sterke base, daarom reageert het met veel soorten zuren. Reageert bijvoorbeeld gemakkelijk met kooldioxide COtwee uit de lucht om bariumcarbonaat BaCO te vormen3.
Het wordt gebruikt bij de vervaardiging van polymeren voor stroomkabels en als ingrediënt voor harsen om gaten in uitgeharde tanden af te dichten.
Bariumoxide (BaO) wordt ook gebruikt in de keramische industrie, zowel voor het bekleden met glazuur als voor de fabricage ervan. Het wordt ook gebruikt in cementmengsels om de druksterkte van het eindproduct te verhogen..
Artikel index
- 1 Structuur
- 2 Nomenclatuur
- 3 Fysieke eigenschappen
- 3.1 Fysieke toestand
- 3.2 Molecuulgewicht
- 3.3 Smeltpunt
- 3.4 Kookpunt
- 3.5 Dichtheid
- 3.6 Oplosbaarheid
- 4 Chemische eigenschappen
- 5 Risico's
- 6 Verkrijgen
- 7 toepassingen
- 7.1 Als droogmiddel voor organische oplosmiddelen
- 7.2 In ontladingslampen
- 7.3 Bij de vervaardiging van keramiek
- 7.4 Bij de bereiding van cementmengsels
- 7.5 In verschillende toepassingen
- 8 referenties
Structuur
Bariumoxide BaO bestaat uit een Ba kationtwee+ en een zuurstofanion Otwee-.
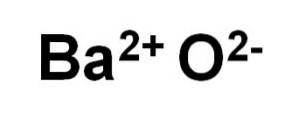
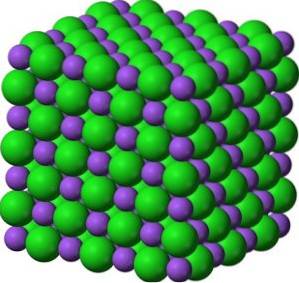
BaO vormt in zijn kristallen kubusvormige ionennetwerken (kubusvormig) van het natriumchloride-type.
De elektronenconfiguratie van het bariumion is: [Xe] 6s0 omdat het de twee elektronen van de 6s-schaal heeft verloren. Deze configuratie is erg stabiel.
Nomenclatuur
-Bariumoxide
-Bariummonoxide
Fysieke eigenschappen
Fysieke toestand
Geelachtig witte kristallijne vaste stof.
Molecuulgewicht
153,33 g / mol
Smeltpunt
1923 ºC
Kookpunt
Ongeveer 2000 ºC.
Dichtheid
5,72 g / cm3
Oplosbaarheid
Enigszins oplosbaar in water: 3,8 g / 100 ml bij 20 ºC.
Chemische eigenschappen
Bariumoxide BaO reageert snel met water, geeft warmte af en vormt een corrosieve oplossing van bariumhydroxide Ba (OH)twee, dat is het meest oplosbare hydroxide onder de aardalkalimetaalhydroxiden.
BaO + HtweeO → Ba (OH)twee
BaO is een sterke basis. Reageert exotherm (d.w.z. met warmteontwikkeling) met alle soorten zuren.
Met COtwee BaO reageert om bariumcarbonaat BaCO te vormen3.
BaO + COtwee → BaCO3
BaO is hygroscopisch, dus als het wordt blootgesteld aan de omgeving, voegt het zich beetje bij beetje samen met de vochtigheid van de lucht en vormt het Ba (OH)twee die combineert met kooldioxide COtwee uit de lucht om bariumcarbonaat BaCO te geven3.
Wanneer bariummonoxide BaO wordt verwarmd in aanwezigheid van lucht, combineert het met zuurstof om bariumperoxide BaO te vormentwee. De reactie is omkeerbaar.
2 BaO + Otwee ⇔ 2 BaOtwee
In aanwezigheid van water kan het reageren met aluminium Al of zink Zn, waarbij de oxiden of hydroxiden van genoemde metalen worden gevormd en waterstofgas H wordt gegenereerdtwee.
Kan de polymerisatie van polymeriseerbare organische verbindingen, zoals epoxiden, initiëren.
Risico's
Kan giftig zijn bij inslikken. Het mag niet in contact komen met de huid. Het is irriterend voor de ogen, huid en luchtwegen. Het kan schadelijk zijn voor het zenuwstelsel. Het kan lage kaliumspiegels veroorzaken, wat resulteert in hart- en spieraandoeningen.
Het verkrijgen van
Bariumoxide BaO kan worden verkregen door bariumcarbonaat BaCO te verhitten3 met houtskool. BaO wordt gevormd en koolmonoxidegas CO komt vrij.
Bacchus3 + C → BaO + 2 CO ↑
Toepassingen
Als droogmiddel voor organische oplosmiddelen
Omdat het gemakkelijk met water reageert, wordt BaO sinds het midden van de vorige eeuw gebruikt als droogmiddel voor benzine en basische of neutrale organische oplosmiddelen..
BaO droogt eromheen zeer actief, het neemt zeer snel vocht op, met vrij veel warmteontwikkeling, waarbij bariumhydroxide Ba (OH) wordt gevormdtwee die stabiel is tot ongeveer 1000 ºC. Om deze reden kan BaO bij hoge temperaturen worden gebruikt..
Het heeft ook een hoog waterabsorptievermogen. Voor elk molecuul BaO kan een van het water en het Ba (OH) worden opgenomentwee resulterende kan ook een bepaalde hoeveelheid water opnemen.
Het is geschikt voor analytische chemielaboratoria. Niet plakkerig.
Het kan worden gebruikt in exsiccatoren, dit zijn grote glazen containers met een deksel waarin de interne omgeving droog wordt gehouden. BaO houdt de miniatuuratmosfeer van de exsiccator droog.

Deze exsiccatoren worden gebruikt om stoffen of reagentia te plaatsen en zo te voorkomen dat ze water uit de omgeving opnemen.
Het wordt ook gebruikt om basische gassen zoals NH-ammoniak te drogen.3.
In ontladingslampen
BaO wordt op de elektroden van ontladingslampen geplaatst als een elektronenemitterend materiaal.
Ontladingslampen zijn gemaakt van een buis van glas, kwarts of ander geschikt materiaal, ze bevatten een inert gas en in de meeste gevallen een metaaldamp. Metaaldamp kan natrium of kwik zijn.

Elektrische ontladingen vinden plaats in de buis omdat deze een positieve en een negatieve elektrode heeft.
De BaO wordt op de elektroden van de lamp geplaatst. De elektronen die het uitzendt, botsen met de atomen van de metaaldamp en geven er energie aan..
Wanneer een elektrische stroom door dit gas of damp gaat, wordt zichtbaar licht of ultraviolette (UV) straling geproduceerd..
Bij de vervaardiging van keramiek
BaO wordt gebruikt in coatingsamenstellingen voor keramische glazuur.

Het is echter ook getest als additief bij de bereiding van glaskeramiek.
BaO verbetert effectief de mechanische eigenschappen en chemische bestendigheid van dit type keramiek. Het heeft een sterke invloed op de thermische eigenschappen en de samenstelling van de kristallijne fase van de verkregen materialen..
Bij de bereiding van cementmengsels
BaO is getest als een component van fosfoaluminaatcement.
Dit type cement is nuttig in maritieme omgevingen, omdat het niet dezelfde neiging heeft om te hydrateren als andere soorten cement, dus het heeft geen last van poriënvorming of uitzetting..
Fosfoaluminaatcementen moeten echter worden versterkt in hun mechanische prestaties om zeestromingen en slagen van drijvende stukken ijs in de oceaan te weerstaan..
De toevoeging van BaO aan het fosfoaluminaatcement wijzigt de minerale structuur van dit materiaal, verbetert de poriënstructuur en verhoogt aanzienlijk de druksterkte van de cementpasta..
Met andere woorden, BaO verbetert de druksterkte van dit type cement..

In verschillende toepassingen
Het wordt gebruikt als een ingrediënt om dekkracht te bieden in tandharsen voor het opvullen van gaten in tanden, uitgevoerd door tandartsen.
Het wordt ook gebruikt als kiemvormingsmiddel voor de bereiding van polyvinylideenfluoridepolymeren die worden gebruikt om stroomkabels te isoleren..
Referenties
- Partyka, J. et al .; (2016). Effect van toevoeging van BaO op het sinteren van glaskeramische materialen uit SiOtwee-Naar detweeOF3-NatweeOKEtweeO-CaO / MgO-systeem. J Therm Anal Calorim (2016) 125: 1095. Opgehaald van link.springer.com.
- Zhang, P. et al. (2019). Effect van BaO op de minerale structuur en het hydratatiegedrag van fosfoaluminaatcement. J Therm Anal Calorim (2019) 136: 2319. Opgehaald van link.springer.com.
- ONS. Nationale bibliotheek van geneeskunde. (2019). Bariumoxide. Opgehaald van pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Verlichting. Beginsel. In Electrical Engineer's Reference Book (zestiende editie). Opgehaald van sciencedirect.com.
- Ebnesajjad, S. (2003). Fluorpolymeer schuimen. Schuimende PVDF. In smeltverwerkbare fluorkunststoffen. Opgehaald van sciencedirect.com.
- Booth, H.S. en McIntyre, L.H. (1930). Bariumoxide als droogmiddel. Ind. Eng. Chem. Anal. Ed.1930, 2, 1, 12-15. Opgehaald van pubs.acs.org.



Niemand heeft nog op dit artikel gereageerd.