
Hoe molaire absorptie en opgeloste oefeningen te berekenen
De molair absorptievermogen het is een chemische eigenschap die aangeeft hoeveel licht een soort in oplossing kan absorberen. Dit concept is erg belangrijk binnen de spectroscopische analyse van absorptie van fotonenstraling met energieën in het ultraviolette en zichtbare bereik (UV-vis)..
Omdat licht is samengesteld uit fotonen met zijn eigen energieën (of golflengten), kan, afhankelijk van de soort of het geanalyseerde mengsel, het ene foton in grotere mate worden geabsorbeerd dan het andere; dat wil zeggen, licht wordt geabsorbeerd bij bepaalde golflengten die kenmerkend zijn voor de stof.

De waarde van het molaire absorptievermogen is dus recht evenredig met de mate van absorptie van licht bij een gegeven golflengte. Als de soort weinig rood licht absorbeert, zal zijn absorptievermogen laag zijn; terwijl als er een uitgesproken absorptie van rood licht is, het absorptievermogen een hoge waarde zal hebben.
Een soort die rood licht absorbeert, zal een groene kleur reflecteren. Als de groene kleur erg intens en donker is, betekent dit dat er een sterke absorptie van rood licht is.
Sommige tinten groen kunnen echter te wijten zijn aan de reflecties van verschillende reeksen geel en blauw, die worden gemengd en waargenomen als turkoois, smaragd, glas, enz..
Artikel index
- 1 Wat is molaire absorptie?
- 1.1 Eenheden
- 2 Hoe het te berekenen?
- 2.1 Directe klaring
- 2.2 Grafische methode
- 3 Opgeloste oefeningen
- 3.1 Oefening 1
- 3.2 Oefening 2
- 4 referenties
Wat is molaire absorptie?
Molaire absorptie is ook bekend onder de volgende benamingen: specifieke extinctie, molaire verzwakkingscoëfficiënt, specifieke absorptie of Bunsen-coëfficiënt; Het is zelfs op andere manieren genoemd geworden, dus het is een bron van verwarring geweest.
Maar wat is molaire absorptie precies? Het is een constante die wordt gedefinieerd in de wiskundige uitdrukking van de Lamber-Beer-wet, en het geeft eenvoudig aan hoeveel de chemische soort of het mengsel licht absorbeert. Zo'n vergelijking is:
A = εbc
Waar A de absorptie is van de oplossing bij een geselecteerde golflengte λ; b is de lengte van de cel waarin het te analyseren monster zich bevindt, en daarom is de afstand die het licht in de oplossing passeert; c is de concentratie van de absorberende soort; en ε, het molaire absorptievermogen.
Gegeven λ, uitgedrukt in nanometers, blijft de waarde van ε constant; maar bij het veranderen van de waarden van λ, dat wil zeggen bij het meten van absorpties met lichten van andere energieën, verandert ε, waarbij een minimum of maximum waarde wordt bereikt.
Als de maximale waarde bekend is, εmax. hoogte, wordt tegelijkertijd λ bepaaldmax. hoogtedat wil zeggen, het licht dat de soort het meest absorbeert:
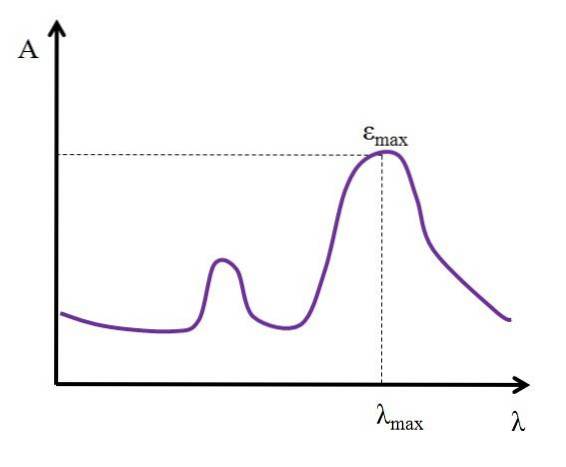
Eenheden
Wat zijn de eenheden van ε? Om ze te vinden, moet bekend zijn dat absorpties dimensieloze waarden zijn; en daarom moet de vermenigvuldiging van de eenheden van b en c opheffen.
De concentratie van de absorberende soort kan worden uitgedrukt in g / L of mol / L, en b wordt meestal uitgedrukt in cm of m (omdat het de lengte is van de cel waar de lichtbundel doorheen gaat). Molariteit is gelijk aan mol / L, dus c wordt ook uitgedrukt als M.
Dus door de eenheden van b en c te vermenigvuldigen, krijgen we: M ∙ cm. Welke eenheden moeten ε dan hebben om de waarde van A dimensieloos te maken? Degenen die M ∙ cm vermenigvuldigen, geven een waarde van 1 (M ∙ cm x U = 1). Als we voor U oplossen, krijgen we eenvoudig M-1∙ cm-1, die ook kan worden geschreven als: L ∙ mol-1∙ cm-1.
Gebruik in feite de M-eenheden-1∙ cm-1 of L ∙ mol-1∙ cm-1 versnellen berekeningen om het molaire absorptievermogen te bepalen. Het wordt echter ook vaak uitgedrukt in eenheden van mtwee/ mol of cmtwee/ mol.
Wanneer uitgedrukt met deze eenheden, moeten enkele omrekeningsfactoren worden gebruikt om de eenheden van b en c te wijzigen.
Hoe het te berekenen?
Directe klaring
Molaire absorptie kan direct worden berekend door het op te lossen in de bovenstaande vergelijking:
ε = A / bc
Als de concentratie van de absorberende soort, de cellengte en de absorptie verkregen bij een golflengte bekend zijn, kan ε worden berekend. Deze manier van berekenen levert echter een onnauwkeurige en onbetrouwbare waarde op.
Grafische methode
Als je de vergelijking van de wet van Lambert-Beer goed bekijkt, zul je zien dat het lijkt op de vergelijking van een lijn (Y = aX + b). Dit betekent dat als de waarden van A op de Y-as worden uitgezet, en die van c op de X-as, er een rechte lijn moet worden verkregen die door de oorsprong (0,0) loopt. A zou dus Y worden, X zou c zijn en a zou gelijk zijn aan εb.
Daarom is het voldoende om, zodra de lijn is getekend, twee punten te nemen om de helling te bepalen, dat wil zeggen een. Zodra dit is gebeurd, en de lengte van de cel, b, bekend is, is het gemakkelijk op te lossen voor de waarde van ε.
In tegenstelling tot directe klaring, maakt het uitzetten van A vs c het mogelijk om de absorptiemetingen te middelen en de experimentele fout te verminderen; en bovendien kunnen oneindige lijnen door een enkel punt gaan, dus directe speling is niet praktisch.
Evenzo kunnen experimentele fouten ervoor zorgen dat een lijn niet door twee, drie of meer punten gaat, dus wordt de lijn verkregen na het toepassen van de methode met de kleinste kwadraten daadwerkelijk gebruikt (een functie die al in rekenmachines is verwerkt). Dit alles uitgaande van een hoge lineariteit en dus naleving van de wet van Lamber-Beer..
Opgeloste oefeningen
Oefening 1
Het is bekend dat een oplossing van een organische verbinding met een concentratie van 0,008739 M een absorptie van 0,6346 vertoonde, gemeten bij λ = 500 nm en met een cellengte van 0,5 cm. Bereken het molaire absorptievermogen van het complex bij deze golflengte.
Uit deze gegevens kan ε direct worden opgelost:
ε = 0,6346 / (0,5 cm) (0,008739 M)
145,23 M-1∙ cm-1
Oefening 2
De volgende absorpties worden gemeten bij verschillende concentraties van een metaalcomplex bij een golflengte van 460 nm en met een cel van 1 cm lang:
A: 0,03010 0,1033 0,1584 0,3961 0,8093
c: 1.8 ∙ 10-5 6 ∙ 10-5 9.2 ∙ 10-5 2,3 ∙ 10-4 5.6 ∙ 10-4
Bereken het molaire absorptievermogen van het complex.
Er zijn in totaal vijf punten. Om ε te berekenen is het nodig om ze in een grafiek te zetten door de waarden van A op de Y-as en de concentraties c op de X-as te plaatsen. Zodra dit is gebeurd, wordt de kleinste-kwadratenlijn bepaald, en met zijn vergelijking kunnen we bepalen ε.
In dit geval de punten uitzetten en de lijn tekenen met een determinatiecoëfficiënt Rtwee 0.9905, de helling is gelijk aan 7 ∙ 10-4dat wil zeggen, εb = 7 ∙ 10-4. Daarom is met b = 1 cm ε 1428,57 M-1.cm-1 (1/7 ∙ 10-4.
Referenties
- Wikipedia. (2018). Molaire verzwakkingscoëfficiënt. Hersteld van: en.wikipedia.org
- Science Struck. (2018). Molaire absorptie. Hersteld van: sciencestruck.com
- Colorimetrische analyse: (wet van Beer of spectrofotometrische analyse). Hersteld van: chem.ucla.edu
- Kerner N. (s.f.). Experiment II - Oplossingskleur, absorptie en bierwet. Hersteld van: umich.edu
- Day, R., & Underwood, A. Kwantitatieve analytische chemie (vijfde ed.). PEARSON Prentice Hall, p-472.
- Gonzáles M. (17 november 2010). Absorptievermogen Hersteld van: quimica.laguia2000.com



Niemand heeft nog op dit artikel gereageerd.