
Amines structuur, eigenschappen, typen, toepassingen, voorbeelden
De aminen het zijn organische verbindingen afgeleid van ammoniak. In hen zijn er covalente bindingen tussen koolstof en stikstof. Natuurlijk is het stikstofmolecuul kinetisch inert; maar dankzij de biologische fixatie wordt het omgezet in ammoniak, dat op zijn beurt daaropvolgende alkyleringsreacties ondergaat.
Wanneer ammoniak wordt "gealkyleerd", vervangt het een, twee of drie van de drie waterstofatomen door koolstofatomen. Deze koolstofatomen kunnen heel goed afkomstig zijn van een alkyl (R) of aryl (Ar) groep. Er zijn dus alifatische aminen (lineair of vertakt) en aromatisch.

De algemene formule voor alifatische aminen is hierboven weergegeven. Deze formule kan worden gebruikt voor aromatische aminen, aangezien R ook een arylgroep Ar kan zijn. Let op de gelijkenis tussen amine en ammoniak, NH3. Praktisch is een H vervangen door een R zijketting.
Als R uit alifatische ketens bestaat, heb je een zogenaamd alkylamine; terwijl als R aromatisch van aard is, een arylamine. Van de arylamines is alanine de belangrijkste: een aminogroep, -NHtwee, gebonden aan de benzeenring.
Als er zuurstofrijke groepen in een moleculaire structuur zijn, zoals OH en COOH, wordt de verbinding niet langer een amine genoemd. In dat geval wordt het amine als een substituent beschouwd: de aminogroep. Dit komt bijvoorbeeld voor in aminozuren, maar ook in andere biomoleculen die van enorm belang zijn voor het leven..
Omdat stikstof wordt aangetroffen in veel van de essentiële verbindingen voor het leven, werden deze als vitale aminen beschouwd; dwz 'vitamines'. Veel van de vitamines zijn echter niet eens amines, en bovendien zijn ze niet allemaal van levensbelang. Dit neemt echter niet weg dat het van groot belang is voor levende organismen..
Aminen zijn sterkere organische basen dan ammoniak zelf. Ze zijn gemakkelijk te extraheren uit plantaardig materiaal en hebben over het algemeen sterke interacties met de neuronale matrix van organismen; vandaar dat veel medicijnen en medicijnen bestaan uit amines met complexe structuren en substituenten.
Artikel index
- 1 Structuur
- 2 Eigenschappen van aminen
- 2.1 Polariteit
- 2.2 Fysieke kenmerken
- 2.3 Oplosbaarheid in water
- 2.4 Basiciteit
- 3 typen (primair, secundair, tertiair)
- 4 Opleiding
- 4.1 Alkylering van ammoniak
- 4.2 Katalytische hydrogenering
- 5 Nomenclatuur
- 6 toepassingen
- 6.1 Kleurstoffen
- 6.2 Drugs en drugs
- 6.3 Gasbehandeling
- 6.4 Landbouwchemie
- 6.5 Vervaardiging van harsen
- 6.6 Dierlijke voedingsstoffen
- 6.7 Rubberindustrie
- 6.8 Oplosmiddelen
- 7 voorbeelden
- 7.1 Cocaïne
- 7.2 Nicotine
- 7.3 Morfine
- 7.4 Serotonine
- 8 referenties
Structuur
Wat is zijn structuur? Hoewel het varieert afhankelijk van de aard van R, is de elektronische omgeving van het stikstofatoom voor allemaal hetzelfde: tetraëdrische. Maar aangezien er een paar niet-gedeelde elektronen op het stikstofatoom (··) is, wordt de moleculaire geometrie piramidaal. Dit is zo met ammoniak en aminen.
Aminen kunnen worden weergegeven door een tetraëder, net als koolstofverbindingen. Dus NH3 en CH4 worden getekend als tetraëders, waarbij het paar (··) zich bevindt op een van de hoekpunten boven de stikstof.
Beide moleculen zijn achiraal; ze beginnen echter chiraliteit te vertonen aangezien hun H's worden vervangen door R. Het amine RtweeNH is achiraal als de twee R's verschillend zijn. Het mist echter een configuratie om het ene enantiomeer van het andere te onderscheiden (zoals het geval is met chirale koolstofcentra).
Dit komt doordat de enantiomeren:
RtweeN-H | H-NRtwee
ze worden zo snel uitgewisseld dat ze zich geen van beiden kunnen isoleren; en daarom worden de structuren van aminen als achiraal beschouwd, ook al zijn alle substituenten op het stikstofatoom verschillend.
Eigenschappen van aminen
Polariteit
Aminen zijn polaire verbindingen, aangezien de aminogroep NHtwee, door een elektronegatief stikstofatoom te hebben, draagt het bij aan het dipoolmoment van het molecuul. Merk op dat stikstof het vermogen heeft om waterstofbruggen af te geven, waardoor amines over het algemeen een hoog kook- en smeltpunt hebben..
Wanneer deze eigenschap echter wordt vergeleken met die van zuurstofhoudende verbindingen, zoals alcoholen en carbonzuren, resulteren ze in lagere waarden..
Bijvoorbeeld het kookpunt van ethylamine, CH3CHtweeNHtwee (16,6 ° C) is lager dan die van ethanol, CH3CHtweeOH (78 ° C).
Er wordt dus aangetoond dat O-H-waterstofbindingen sterker zijn dan die van N-H, ook al kan een amine meer dan één brug vormen. Deze vergelijking is alleen geldig als R hetzelfde molecuulgewicht heeft voor de twee verbindingen (CH3CHtwee-Aan de andere kant kookt ethaan bij -89ºC, CH3CH3, een gas zijn bij kamertemperatuur.
Omdat een amine minder waterstof bevat, vormt het minder waterstofbruggen en wordt het kookpunt verlaagd. Dit wordt gezien door het kookpunt van dimethylamine, (CH3tweeNH (7 ° C), met die van ethylamine (16,6 ° C).
Fysieke eigenschappen
Als je in de chemie over een amine praat, ontstaat de onvrijwillige handeling van het vasthouden van je neus. Dit komt omdat ze over het algemeen de neiging hebben om onaangename geuren te hebben, waarvan sommige gaan lijken op die van rotte vis..
Bovendien hebben vloeibare amines de neiging gelige tinten te hebben, waardoor het visuele wantrouwen dat ze opwekken, toeneemt..
Oplosbaarheid in water
Aminen zijn meestal onoplosbaar in water omdat ze, ondanks dat ze in staat zijn om waterstofbruggen te vormen met HtweeOf zijn belangrijkste organische component is hydrofoob. Hoe groter of langer de R-groepen, hoe lager hun oplosbaarheid in water..
Wanneer er echter een zuur in het medium zit, wordt de oplosbaarheid verhoogd door de vorming van zogenaamde aminezouten. Daarin heeft stikstof een positieve gedeeltelijke lading, die elektrostatisch het anion of de geconjugeerde base van het zuur aantrekt..
Bijvoorbeeld in een verdunde oplossing van HCl, het amine RNHtwee reageert als volgt:
RNHtwee + HCl => RNH3+Cl- (primair zout van amine)
RNHtwee Het was onoplosbaar (of enigszins oplosbaar) in water en vormt in aanwezigheid van het zuur een zout, waarvan het oplossen van de ionen de oplosbaarheid bevordert.
Waarom gebeurt dit? Het antwoord ligt in een van de belangrijkste eigenschappen van amines: ze zijn polair en basisch. Omdat ze basisch zijn, zullen ze reageren met zuren die sterk genoeg zijn om ze te protoneren, volgens de definitie van Brönsted-Lowry..
Basiciteit
Aminen zijn sterkere organische basen dan ammoniak. Hoe hoger de elektronendichtheid rond het stikstofatoom, hoe basischer het zal zijn; dat wil zeggen, het zal de zuren in het milieu sneller deprotoneren. Als het amine erg basisch is, kan het zelfs het proton uit alcoholen stelen.
De R groepen dragen elektronendichtheid bij aan stikstof door inductief effect; aangezien we niet mogen vergeten dat het een van de meest elektronegatieve atomen is die er bestaan. Als deze groepen erg lang of omvangrijk zijn, zal het inductieve effect groter zijn, waardoor ook het negatieve gebied rond het elektronenpaar (··) groter wordt..
Dit zorgt ervoor dat (··) het H-ion sneller accepteert+. Als R echter erg omvangrijk is, neemt de basiciteit af vanwege het sterische effect. Waarom? Om de simpele reden dat de H+ moet een configuratie van atomen doorkruisen alvorens stikstof te bereiken.
Een andere manier om over de basiciteit van een amine te redeneren, is door het aminezout ervan te stabiliseren. Nu kan degene die afneemt door een inductief effect de positieve lading N verminderen+, het zal een meer basale amine zijn. De redenen zijn hetzelfde, zojuist uitgelegd.
Alkylamines versus arylamines
Alkylamines zijn veel basischer dan arylamines. Waarom? Om het eenvoudig te begrijpen, wordt de structuur van aniline getoond:
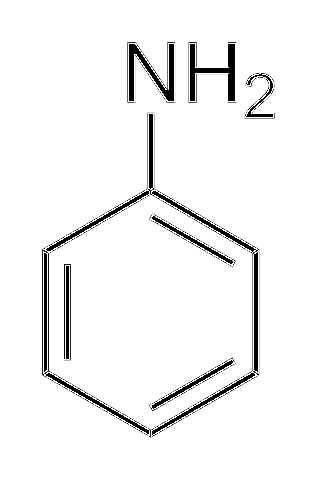
Boven, in de aminogroep, bevindt zich het elektronenpaar (··). Dit paar "reist" binnen de ring in de ortho- en paraposities ten opzichte van NHtwee. Het betekent dat de twee bovenste hoekpunten en het tegenovergestelde van NHtwee zijn negatief geladen, terwijl het stikstofatoom positief geladen is.
Omdat de stikstof positief geladen is, +N, zal het H-ion afstoten+. En alsof dit nog niet genoeg is, wordt het elektronenpaar binnen de aromatische ring gedelokaliseerd, waardoor het minder toegankelijk wordt voor deprotonering van zuren..
De basiciteit van aniline kan toenemen als groepen of atomen die het elektronische dichtheid geven, worden gekoppeld aan de ring, concurreren met het paar (··) en het dwingen om met grotere waarschijnlijkheid op het stikstofatoom te worden gelokaliseerd, klaar om als een basis te fungeren.
Typen (primair, secundair, tertiair)

Hoewel niet formeel gepresenteerd, is er impliciet verwezen naar primaire, secundaire en tertiaire aminen (bovenste afbeelding, van links naar rechts).
Primaire aminen (RNHtwee) zijn de mono-gesubstitueerde; de secundaire (RtweeNH), zijn tweevoudig gesubstitueerd met twee R-alkyl- of arylgroepen; en de tertiaire (R3N), zijn tri-gesubstitueerd en ontbreekt aan waterstof.
Alle bestaande aminen zijn afgeleid van deze drie typen, dus hun diversiteit en interacties met de biologische en neuronale matrix zijn enorm.
In het algemeen kan worden verwacht dat tertiaire aminen de meest basale zijn; Een dergelijke verklaring kan echter niet worden gedaan zonder de structuren van R te kennen.
Opleiding
Ammoniak-alkylering
In eerste instantie werd vermeld dat aminen zijn afgeleid van ammoniak; daarom is de eenvoudigste manier om ze te vormen door ze te alkyleren. Om dit te doen, wordt een overmaat ammoniak omgezet met een alkylhalogenide, gevolgd door de toevoeging van een base om het aminezout te neutraliseren:
NH3 + RX => RNH3+X- => RNHtwee
Merk op dat deze stappen leiden tot een primair amine. Er kunnen ook secundaire en zelfs tertiaire aminen worden gevormd, waardoor de opbrengst voor een enkel product afneemt.
Sommige trainingsmethoden, zoals de Gabriel-synthese, maken het mogelijk om primaire aminen te verkrijgen, zodat er geen andere ongewenste producten worden gevormd.
Ook kunnen ketonen en aldehyden worden gereduceerd in aanwezigheid van ammoniak en primaire aminen, waardoor secundaire en tertiaire aminen ontstaan..
Katalytische hydrogenering
Nitroverbindingen kunnen worden gereduceerd in aanwezigheid van waterstof en een katalysator tot hun overeenkomstige aminen.
ArNOtwee => ArNHtwee
Nitrilen, RC≡N en amiden, RCONRtwee, worden ook gereduceerd om respectievelijk primaire en tertiaire aminen te geven.
Nomenclatuur
Hoe worden amines genoemd? Meestal worden ze genoemd op basis van R, de alkyl- of arylgroep. Aan de naam van R, afgeleid van zijn alkaan, wordt aan het einde het woord 'amine' toegevoegd.
Dus CH3CHtweeCHtweeNHtwee is propylamine. Aan de andere kant kan het worden genoemd als alleen het alkaan wordt beschouwd en niet als een R-groep: propanamine.
De eerste manier om ze te benoemen is verreweg de bekendste en meest gebruikte.
Als er twee NH-groepen zijntwee, het alkaan wordt genoemd en de posities van de aminogroepen worden vermeld. Dus de HtweeNCHtweeCHtweeCHtweeCHtweeNHtwee heet: 1,4-butaandiamine.
Als er zuurstofrijke groepen zijn, zoals OH, moet deze prioriteit krijgen boven NHtwee, die toevallig wordt genoemd als een substituent. Bijvoorbeeld HOCHtweeCHtweeCHtweeNHtwee Het heet: 3-Aminopropanol.
En met betrekking tot secundaire en tertiaire aminen, worden de letters N gebruikt om de groepen R aan te geven. De langste ketting blijft bij de naam van de verbinding. Dus de ch3NHCHtweeCH3 Het heet: N-Methylethylamine.
Toepassingen
Kleurstoffen
Primaire aromatische aminen kunnen dienen als uitgangsmateriaal voor azo-kleurstofsynthese. Aanvankelijk reageren aminen om diazoniumzouten te vormen, die azoverbindingen vormen door azokoppeling (of diazokoppeling)..
Deze worden vanwege hun intense kleur in de textielindustrie gebruikt als verfmateriaal; bijvoorbeeld: methyloranje, direct bruin 138, zonnegeel FCF en ponceau.
Drugs en drugs
Veel medicijnen werken met agonisten en antagonisten van natuurlijke amine-neurotransmitters. Voorbeelden:
-Chloorfeniramine is een antihistaminicum dat wordt gebruikt bij de bestrijding van allergische processen als gevolg van de inname van bepaalde voedingsmiddelen, hooikoorts, insectenbeten, enz..
-Chloorpromazine is een kalmerend middel, geen slaapverwekkende stof. Verlicht angst en wordt zelfs gebruikt bij de behandeling van sommige psychische stoornissen.
-Efedrine en fenylefedrine worden gebruikt als decongestiva voor de luchtwegen.
-Amitriptyline en imipramine zijn tertiaire aminen die worden gebruikt bij de behandeling van depressie. Vanwege hun structuur worden ze geclassificeerd als tricyclische antidepressiva..
-Opioïde pijnstillers zoals morfine, codeline en heroïne zijn tertiaire aminen.
Gasbehandeling
Verschillende aminen, waaronder diglycolamine (DGA) en diethanolamine (DEA), worden gebruikt bij de eliminatie van kooldioxide (COtwee) en waterstofsulfide (H.tweeS) aanwezig in aardgas en raffinaderijen.
Agrarische chemie
Methylamines zijn tussenproducten bij de synthese van chemicaliën die in de landbouw worden gebruikt als herbiciden, fungiciden, insecticiden en biociden.
Hars fabricage
Methylamines worden gebruikt bij de productie van ionenuitwisselingsharsen, bruikbaar bij de deïonisatie van water.
Dierlijke voedingsstoffen
Trimethylamine (TMA) wordt voornamelijk gebruikt bij de productie van cholinechloride, een vitamine B-supplement dat wordt gebruikt in het voer van kippen, kalkoenen en varkens..
Rubberindustrie
Dimethylamine-oleaat (DMA) is een emulgator voor gebruik bij de productie van synthetisch rubber. DMA wordt direct gebruikt als polymerisatiemodificator in de dampfase van butadieen en als stabilisator voor natuurlijke rubberlatex in plaats van ammoniak
Oplosmiddelen
Dimethylamine (DMA) en monomethylamine (MMA) worden gebruikt om de aprotische polaire oplosmiddelen dimethylformamide (DMF), dimethylaceetamide (DMAc) en n-methylpyrrolidon (NMP) te synthetiseren.
Toepassingen voor DMF zijn onder meer: urethaancoating, acrylgarenoplosmiddel, reactieoplosmiddelen en extractieoplosmiddelen.
DMAc wordt gebruikt bij de vervaardiging van garenkleurstoffen en oplosmiddelen. Ten slotte wordt NMP gebruikt bij de raffinage van smeeroliën, verfafbijtmiddel en emailcoating..
Voorbeelden
Cocaïne
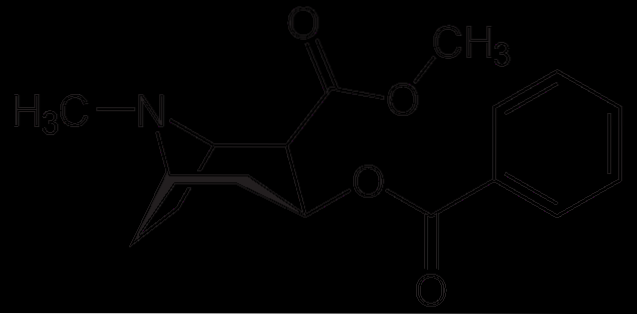
Cocaïne wordt gebruikt als plaatselijke verdoving bij bepaalde soorten oog-, oor- en keeloperaties. Zoals te zien is het een tertiair amine.
Nicotine

Nicotine is het belangrijkste middel van tabaksverslaving en chemisch gezien is het een tertiair amine. De nicotine in tabaksrook wordt snel opgenomen en is zeer giftig.
Morfine
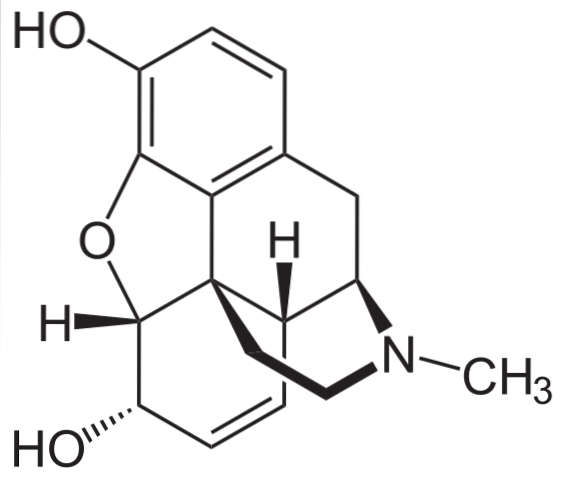
Het is een van de meest effectieve pijnstillers om pijn te verlichten, vooral kanker. Het is wederom een tertiair amine.
Serotonine

Serotonine is een amine-neurotransmitter. Bij depressieve patiënten is de concentratie van de belangrijkste metaboliet van serotonine verlaagd. In tegenstelling tot de andere amines, is deze primair.
Referenties
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10th editie.). Wiley plus.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley Iberoamericana.
- The Chemours Company. (2018). Methylamines: gebruik en toepassingen. Hersteld van: chemours.com
- Transparantie Marktonderzoek. (s.f.). Amines: belangrijke feiten en toepassingen. Hersteld van: transparentmarketresearch.com
- Wikipedia. (2019). Amine. Hersteld van: en.wikipedia.org
- Ganong, W. F. (2003). Medische fysiologie. 19e editie. Redactioneel The Modern Manual.



Niemand heeft nog op dit artikel gereageerd.