
Acetanilide (C8H9NO) Structuur, eigenschappen, synthese
De aceetanilide (C8H9NO) is een aromatisch amide dat verschillende aanvullende namen krijgt: N-acetylarylamine, N-fenylaceetamide en acetanil. Het wordt gepresenteerd als een reukloze vaste stof in de vorm van vlokken, de chemische aard ervan is amide en als zodanig kan het brandbare gassen vormen bij reactie met sterk reducerende middelen..
Bovendien is het een zwakke base, die kan reageren met dehydratatiemiddelen zoals PtweeOF5 om een nitril te doen ontstaan. Acetanilide bleek een pijnstillende en koortswerende werking te hebben en werd in 1886 onder de naam Antifebrina gebruikt door A. Cahn en P. Hepp..

In 1899 werd acetylsalicylzuur (aspirine) op de markt gebracht, dat dezelfde therapeutische werking had als acetanilide. Omdat het gebruik van aceetanilide verband hield met het optreden van cyanose bij patiënten - een gevolg van door acetanilide geïnduceerde methemoglobinemie - werd het gebruik ervan uitgesloten..
Vervolgens werd vastgesteld dat de pijnstillende en koortswerende werking van aceetanilide in een metaboliet ervan, paracetamol (acetoaminofen) genaamd, zat, die geen toxische effecten had, zoals gesuggereerd door Axelrod en Brodie..
Artikel index
- 1 Chemische structuur
- 1.1 Resonantiestructuren en intermoleculaire interacties
- 2 Chemische eigenschappen
- 2.1 Molecuulgewicht
- 2.2 Chemische beschrijving
- 2.3 Geur
- 2.4 Smaak
- 2.5 Kookpunt
- 2.6 Smeltpunt
- 2.7 Vlampunt of vlampunt
- 2.8 Dichtheid
- 2.9 Dampdichtheid
- 2.10 Dampspanning
- 2.11 Stabiliteit
- 2.12 Volatiliteit
- 2.13 Zelfontbranding
- 2.14 Ontleding
- 2,15 pH
- 2.16 Oplosbaarheid
- 3 Synthese
- 4 Toepassingen
- 5 referenties
Chemische structuur
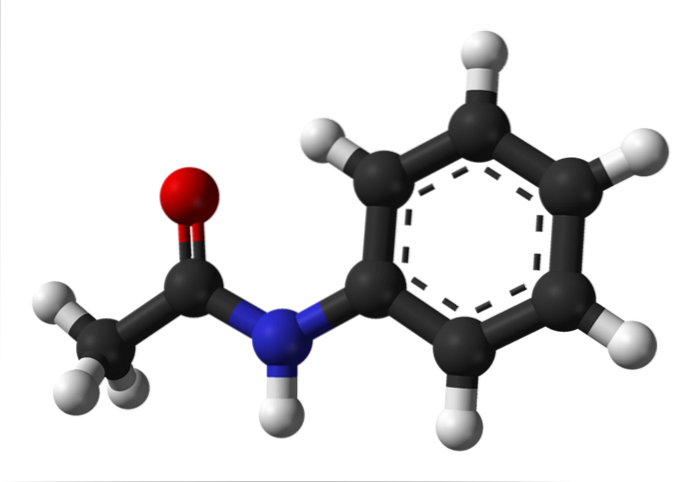
De bovenste afbeelding geeft de chemische structuur van aceetanilide weer. Aan de rechterkant is de hexagonale aromatische ring van benzeen (met stippellijnen), en aan de linkerkant is de reden waarom de verbinding bestaat uit een aromatisch amide: de acetamidogroep (HNCOCH3.
De aceetamidogroep geeft de benzeenring een groter polair karakter; dat wil zeggen, het creëert een dipoolmoment in het aceetanilidemolecuul.
Waarom? Omdat stikstof elektronegatiever is dan elk van de koolstofatomen in de ring en ook is gebonden aan de acylgroep, waarvan het O-atoom ook elektronendichtheid aantrekt.
Aan de andere kant rust bijna de gehele moleculaire structuur van aceetanilide op hetzelfde vlak als gevolg van sp-hybridisatietwee van de atomen waaruit het bestaat.
Er is een uitzondering gekoppeld aan die van de -CH-groep3, waarvan de waterstofatomen de hoekpunten van een tetraëder vormen (de witte bollen helemaal links komen uit het vlak).
Resonantiestructuren en intermoleculaire interacties
Het eenzame paar zonder te delen in het N-atoom circuleert door het π-systeem van de aromatische ring en veroorzaakt verschillende resonantiestructuren. Een van deze structuren eindigt echter met een negatieve lading op het O-atoom (meer elektronegatief) en een positieve lading op het N-atoom..
Er zijn dus resonantiestructuren waarbij een negatieve lading in de ring beweegt en een andere waar deze zich in het O-atoom bevindt. Als gevolg van deze 'elektronische asymmetrie', die hand in hand gaat met moleculaire asymmetrie, werkt aceetanilide intermoleculair samen door dipool. -dipole krachten.
Interacties met waterstofbruggen (N-H-O-…) tussen twee aceetanilidemoleculen zijn echter in feite de overheersende kracht in hun kristallijne structuur..
Acetanilidekristallen bestaan dus uit orthorhombische eenheidscellen van acht moleculen die door hun waterstofbruggen in "platte band" -vormen zijn georiënteerd..
Dit kan worden gevisualiseerd door het ene acetanilidemolecuul parallel op het andere te plaatsen. Dus, zoals de HNCOCH-groepen3 overlappen elkaar ruimtelijk, ze vormen waterstofbruggen.
Bovendien kan tussen deze twee moleculen een derde ook "glijden", maar met zijn aromatische ring naar de andere kant gericht..
Chemische eigenschappen
Molecuulgewicht
135,166 g / mol.
Chemische beschrijving
Effen wit of gebroken wit. Vormt glanzende witte vlokken of een wit kristallijn poeder.
Geur
Toilet.
Smaak
Licht pittig.
Kookpunt
304 ° C tot 760 mmHg (579 ° F tot 760 mmHg).
Smeltpunt
114,3 ° C (237,7 ° F).
Vlampunt of vlampunt
169 ° C (337 ° F). Meting uitgevoerd in open glas.
Dichtheid
1.219 mg / ml bij 15 ° C (1.219 mg / ml bij 59 ° F)
Dampdichtheid
4,65 ten opzichte van lucht.
Dampdruk
1 mmHg bij 237 ° F, 1,22 × 10-3 mmHg bij 25 ° C, 2 Pa bij 20 ° C.
Stabiliteit
Het ondergaat een chemische herschikking bij blootstelling aan UV-licht. Hoe verandert de structuur? De acetylgroep vormt nieuwe bindingen op de ring op de ortho- en paraposities. Bovendien is het stabiel in lucht en onverenigbaar met sterke oxidatiemiddelen, logen en logen..
Beweeglijkheid
Bij 95 ºC opmerkelijk vluchtig.
Zelfontbranding
1004ºF.
Ontleding
Het ontleedt bij verhitting en geeft een zeer giftige rook af.
pH
5-7 (10 g / L van HtweeOf bij 25 ºC)
Oplosbaarheid
- In water: 6,93 × 103 mg / ml bij 25 ºC.
- Oplosbaarheid van 1 g aceetanilide in verschillende vloeistoffen: in 3,4 ml alcohol, 20 ml kokend water, 3 ml methanol, 4 ml aceton, 0,6 ml kokende alcohol, 3,7 ml chloroform, 5 ml gliecerol, 8 ml dioxaan, 47 ml benzeen en 18 ml ether. Chloorhydraat verhoogt de oplosbaarheid van aceetanilide in water.
Synthese
Het wordt gesynthetiseerd door azijnzuuranhydride te laten reageren met aceetanilide. Deze reactie komt in veel teksten van Organic Chemistry (Vogel, 1959) voor:
C6H.5NHtwee + (CH3CO)tweeO => C6H.5NHCOCH3 + CH3COOH
Toepassingen
-Het is een remmer van het afbraakproces van waterstofperoxide (waterstofperoxide).
-Stabiliseert cellulose-estervernis.
-Het grijpt in als tussenpersoon bij de versnelling van de rubberproductie. Evenzo is het een tussenpersoon bij de synthese van sommige kleurstoffen en kamfer..
-Werkt als een voorloper bij de synthese van penicilline.
-Het wordt gebruikt bij de productie van 4-acetamidosulfonylbenzeenchloride. Acetanilide reageert met chloorsulfonzuur (HSO3Cl), waardoor 4-aminosulfonylbenzeenchloride wordt geproduceerd. Dit reageert met ammoniak of een primair organisch amine om sulfonamiden te vormen..
-Het werd in de 19e eeuw experimenteel gebruikt bij de ontwikkeling van fotografie.
-Acetanilide wordt gebruikt als een marker van elektro-osmotische fluxen (EOF) in capillaire elektroforese voor de studie van het verband tussen geneesmiddelen en eiwitten..
-Onlangs (2016) is aceetanilide in experimenten gekoppeld aan 1- (ω-fenoxyalkyluracil) om de replicatie van het hepatitis C-virus te remmen. Acetanilide bindt aan positie 3 van de pyrimidinering.
-De experimentele resultaten duiden op een vermindering van de replicatie van het virale genoom, ongeacht het virale genotype..
-Voordat de toxiciteit van aceetanilide werd vastgesteld, werd het vanaf 1886 als pijnstiller en koortswerend middel gebruikt. Later (1891) werd het door Grün gebruikt bij de behandeling van chronische en acute bronchitis..
Referenties
- J. Brown & D. E. C. Corbridge. (1948). Kristalstructuur van acetanilide: gebruik van gepolariseerde infraroodstraling. Nature volume 162, pagina 72. doi: 10.1038 / 162072a0.
- Grün, E. F. (1891) Het gebruik van aceetanilide bij de behandeling van acute en chronische bronchitis. Lancet 137 (3539): 1424-1426.
- Magri, A. et al. (2016). Onderzoek naar aceetanilidederivaten van 1- (ω-fenoxyalkyl) uracils als nieuwe remmers van replicatie van het hepatitis C-virus. Sci Rep.6, 29487; doi: 10.1038 / srep29487.
- Merck KGaA. (2018). Acetanilide. Opgehaald op 5 juni 2018, van: sigmaaldrich.com
- SIDS Initial Assessment Report voor 13e SIAM. Acetanilide. [Pdf]. Opgehaald op 5 juni 2018, van: inchem.org
- Wikipedia. (2018). Acetanilide. Opgehaald op 5 juni 2018, van: en.wikipedia.org
- PubChem. (2018). Acetanilide. Opgehaald op 5 juni 2018, van: pubchem.ncbi.nlm.nih.gov



Niemand heeft nog op dit artikel gereageerd.