
Acetonitril (C2H3N) Structuur, eigenschappen, gebruik
De acetonitril Het is een stof van organische oorsprong die alleen uit koolstof, waterstof en stikstof bestaat. Deze chemische soort behoort tot de groep van nitrilen, waarbij acetonitril degene is met de eenvoudigste structuur van die van het organische type..
Nitrilen zijn een klasse van chemische verbindingen waarvan de structuur bestaat uit een cyanidegroep (CN-) en een radicale keten (-R). Deze elementen worden weergegeven door de volgende algemene formule: R-C≡N.
Het is bekend dat deze stof voornamelijk is ontstaan tijdens de productie van een andere soort, acrylonitril genaamd (een ander eenvoudig nitril, met molecuulformule C3H.3N, dat wordt gebruikt bij de vervaardiging van producten in de textielindustrie) als bijproduct daarvan.
Bovendien wordt acetonitril beschouwd als een oplosmiddel met gemiddelde polariteitseigenschappen, en daarom wordt het vrij regelmatig gebruikt in RP-HPLC-analyses (reverse phase high performance liquid chromatography)..
Artikel index
- 1 Structuur
- 2 Eigenschappen
- 3 toepassingen
- 4 Risico's
- 5 referenties
Structuur
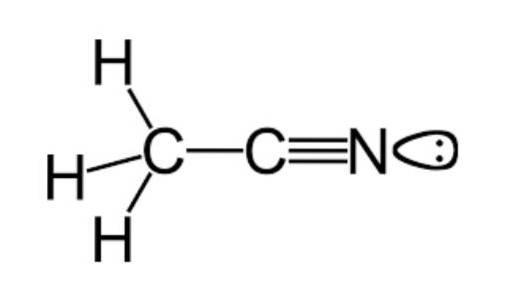
Zoals eerder vermeld, behoort acetonitril tot de functionele groep van nitrilen, met een molecuulformule die gewoonlijk wordt weergegeven als CtweeH.3N, die te zien is in de structuurformule die wordt geïllustreerd in de bovenste figuur.
Op deze afbeelding is een soort lob te zien die aan het stikstofatoom is bevestigd, die het paar ongepaarde elektronen vertegenwoordigt dat dit atoom heeft en die het een groot deel van de reactiviteit en stabiliteitseigenschappen geven die er kenmerkend voor zijn..
Op deze manier vertoont deze soort een heel bijzonder gedrag vanwege zijn structurele opstelling, wat zich vertaalt in zwakte om waterstofbruggen te ontvangen en weinig vermogen om elektronen te doneren..
Ook is deze stof voor het eerst ontstaan in de tweede helft van de jaren 1840, vervaardigd door de wetenschapper genaamd Jean-Baptiste Dumas, wiens nationaliteit de Franse was..
De structurele conformatie van deze stof zorgt ervoor dat het de kenmerken heeft van zijn eigen oplosmiddel van organische aard..
Deze eigenschap maakt het op zijn beurt mogelijk dat acetonitril wordt gemengd met water, evenals een reeks andere oplosmiddelen van organische oorsprong, met uitzondering van koolwaterstoffen of verzadigde koolwaterstofsoorten..
Eigendommen
Deze verbinding heeft een reeks eigenschappen die hem onderscheiden van andere in dezelfde klasse, die hieronder worden vermeld:
- Het bevindt zich in een vloeibare toestand van aggregatie onder standaardomstandigheden van druk en temperatuur (1 atm en 25 ° C).
- Zijn moleculaire configuratie geeft het een molecuulgewicht of molecuulgewicht van ongeveer 41 g / mol.
- Het wordt beschouwd als het nitril met de eenvoudigste structuur van het organische type.
- Door zijn optische eigenschappen is het kleurloos in deze vloeistoffase en heeft het heldere eigenschappen, naast een aromatische geur..
- Het heeft een vlampunt van ongeveer 2 ° C, wat overeenkomt met 35,6 ° F of 275,1 K..
- Het heeft een kookpunt in het bereik van 81,3 tot 82,1 ° C, een dichtheid van ongeveer 0,786 g / cm3 en een smeltpunt dat tussen -46 en -44 ° C ligt.
- Het is minder dicht dan water, maar mengbaar ermee en met een verscheidenheid aan organische oplosmiddelen.
- Het vertoont een diëlektrische constante van 38,8 naast een dipoolmoment van ongeveer 3,92 D.
- Het is in staat een grote verscheidenheid aan stoffen van ionische oorsprong en niet-polaire aard op te lossen.
- Het wordt veel gebruikt als een mobiele fase in HPLC-analyse, die eigenschappen met een hoge ontvlambaarheid heeft.
Toepassingen
Onder het grote aantal toepassingen dat acetonitril heeft, kunnen de volgende worden geteld:
- Evenzo kunnen andere soorten nitrilen een metabolisatieproces ondergaan in microsomen (vesiculaire elementen die deel uitmaken van de lever), vooral in dit orgaan, om blauwzuur te produceren..
- Het wordt veel gebruikt als een mobiele fase in het type analyse dat high-performance vloeistofchromatografie met omgekeerde fase (RP-HPLC) wordt genoemd; dat wil zeggen als een eluerende stof met een hoge stabiliteit, een groot elutievermogen en een lage viscositeit.
- In het geval van toepassingen van industriële omvang wordt deze chemische verbinding in ruwe olieraffinaderijen gebruikt als oplosmiddel bij bepaalde processen, zoals de zuivering van het alkeen dat butadieen wordt genoemd..
- Het wordt ook gebruikt als een ligand (chemische soort die combineert met een atoom van een metaalelement, beschouwd als centraal in het gegeven molecuul, om een verbinding of coördinatiecomplex te vormen) in een groot aantal nitrilverbindingen met metalen van de overgangsgroep.
- Evenzo wordt het in de organische synthese gebruikt voor een groot aantal van dergelijke voordelige chemicaliën zoals a-naftaleenazijnzuur, thiamine of aceetamidine-hydrochloride..
Risico's
De risico's van blootstelling aan acetonitril zijn divers. Onder deze is een verminderde toxiciteit wanneer de blootstelling gedurende een kortere tijdsperiode en in kleine hoeveelheden plaatsvindt, en wordt gemetaboliseerd voor de productie van blauwzuur..
Evenzo zijn er zelden gevallen geregistreerd van mensen die zijn vergiftigd met deze chemische soort, die zijn vergiftigd door het cyanide dat in het molecuul aanwezig is nadat ze in verschillende mate in contact zijn geweest met acetonitril (bij inademing, opname of opname door de huid).
Om deze reden worden de gevolgen van de toxiciteit vertraagd omdat het lichaam deze stof niet gemakkelijk in cyanide omzet, aangezien het twee tot twaalf uur duurt voordat dit gebeurt..
Acetonitril wordt echter gemakkelijk geabsorbeerd uit de longen en het maagdarmkanaal. Vervolgens vindt de distributie ervan door het hele lichaam plaats, gebeurt bij mensen en zelfs bij dieren en bereikt het de nieren en milt..
Aan de andere kant is acetonitril, naast de ontvlambaarheidsrisico's die het met zich meebrengt, een precursor van stoffen die zo giftig zijn als blauwzuur of formaldehyde. Het gebruik ervan in producten die tot het cosmetische gebied behoren, was in 2000 zelfs verboden in de zogenaamde Europese Economische Ruimte..
Referenties
- Wikipedia. (s.f.). Acetonitril. Opgehaald van en.wikipedia.org
- PubChem. (s.f.). Acetonitril. Opgehaald van pubchem.ncbi.nlm.nih.gov
- Brown, P. R. (2000). Vooruitgang in chromatografie. Opgehaald van books.google.co.ve
- ScienceDirect. (s.f.). Acetonitril. Opgehaald van sciencedirect.com
- ChemSpider. (s.f.). Acetonitril. Opgehaald van chemspider.com


Niemand heeft nog op dit artikel gereageerd.