
Maïsmeel agar foundation, bereiding en gebruik

De maïsmeel-agar is een vast kweekmedium, met een laag voedingsvermogen, nuttig voor de onderkweek van bepaalde schimmels en voor het aantonen van chlamydosporen in stammen van het complex Candida albicans. In het Engels staat het bekend als Corn Meal Agar.
Het conventionele maïsmeelmedium heeft een zeer eenvoudige samenstelling, het bevat maïsmeel, agar-agar en water. Vanwege het lage voedingsniveau is het ideaal voor gebruik bij het onderhoud van schimmelstammen gedurende gematigde perioden, vooral zwarte schimmels..
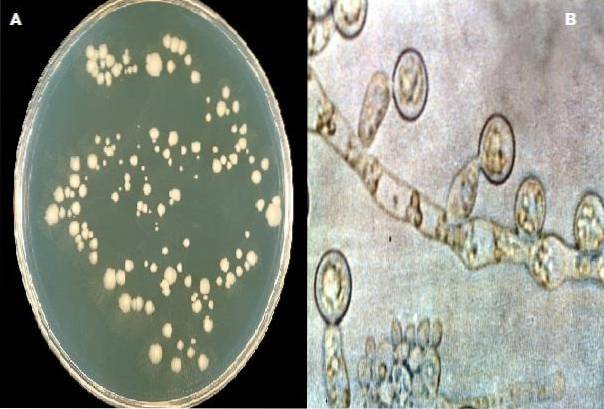
Sporulatie van het complex Candida albicans in dit medium heeft het de voorkeur als 1% Tween 80 wordt toegevoegd tijdens de bereiding van de agar. De vorming van chlamydosporen is kenmerkend voor deze soort en praktisch de enige die mensen treft..
Er zijn andere soorten die chlamydosporen vormen, maar het is onwaarschijnlijk dat ze mensen beïnvloeden, zoals Candida australis, aanwezig in pinguïnuitwerpselen, of C. clausenii, wat een zelden gevonden saprofiet is. Evenzo uitzonderlijk de soort C. stellatoidea Y C. tropicalis zou ze kunnen vormen.
Aan de andere kant bevordert de toevoeging van glucose aan het maïsmeelmedium de vorming van pigmenten in stammen van Trichophytom rubrum.
Het is belangrijk op te merken dat er schimmels zijn die geen hyfen of pseudohyfen vormen in maïsmeelagar, zoals Cryptococcus neoformans, differentiëren van andere genres.
Maïsmeel-agar kan in het laboratorium zelfgemaakt worden of commerciële media kunnen ook worden gebruikt..
Artikel index
- 1 Grondgedachte
- 2 Voorbereiding
- 2.1 Commerciële maïsmeelagar
- 2.2 Maïsmeel-agar met Tween 80
- 2.3 Maïsmeel-agar met glucose
- 3 Gebruik
- 3.1 Zaaien
- 3.2 Demonstratie van chlamydosporen
- 3.3 Onderhoud van schimmelstammen
- 4 Kwaliteitscontrole
- 5 Beperkingen
- 6 referenties
Basis
Maïsmeel is het substraat, agar is het stollingsmiddel en water is het oplosmiddel..
Maïsmeelagar kan worden aangevuld met tween 80 (sorbitanmonooleaat of polysorbaatpolyester 80). Deze verbinding vermindert de oppervlaktespanning van het medium vanwege zijn emulgerende kracht.
Het creëert ook een vijandige omgeving die overdreven celvermenigvuldiging remt en de groei van hyfen stimuleert, wat ook de productie van chlamydosporen bevordert; de laatste beschouwde verzetsstructuren. Deze structuur helpt bij de identificatie van de soort Candida albicans.
Glucose in dit medium verhoogt op zijn beurt het pigmentvormend vermogen van sommige schimmels..
Opgemerkt moet worden dat het medium glucose maïsmeel niet dient om chlamydosporen in cCandida albicans-complex.
Voorbereiding
Zelfgemaakte Maïsmeel Agar Voorbereiding
Weeg 47 g gele maïsmeel af en los op in 500 ml gedestilleerd water. Verwarm tot 60 ºC, al roerend, gedurende ongeveer 1 uur. Filter vervolgens door een stuk gaas en katoen, eventueel kan het weer worden gefilterd door het preparaat door een Whatman nr. 2 filtreerpapier te voeren.
Vul met gedestilleerd water aan tot 1000 ml. Voeg 17 g agar-agar toe, verwarm tot het is opgelost. Autoclaaf gedurende 15 minuten bij 121 ºC.
Serveer in steriele petrischalen. Bewaar in de koelkast.
De kleur van het bereide medium is witachtig met een klonterig uiterlijk.
Als je aan het hierboven beschreven preparaat maïsmeel met glucose wilt bereiden, voeg dan 10 g glucose toe.
Commerciële maïsmeel-agar
Weeg 17 g van het gedehydrateerde medium af en los op in 1 liter gedestilleerd water. Het mengsel kan worden verwarmd, zachtjes schudden om volledig op te lossen. Steriliseer gedurende 15 minuten in een autoclaaf bij 121 ºC, bij 15 lb..
Giet in steriele petrischalen. Laat stollen. Omkeren en tot gebruik in de koelkast bewaren. Tempereer voor gebruik.
De pH moet 6,0 ± 0,2 zijn bij 25 ºC.
Maïsmeel-agar met Tween 80
Om te voldoen aan ISO 18416, moet maïsmeelagar als volgt worden bereid:
Weeg 65 gram per liter af en voeg 10 ml Tween 80 toe. Verhit en kook gedurende enkele minuten tot het is opgelost, zorg ervoor dat je niet te veel oververhit. Steriliseer 15 minuten op 121 ºC.
Maïsmeel-agar met glucose
Om de chromogene kracht van kolonies van Trichophyton rubrum en onderscheid ze van T. mentagrophytes, 0,2% glucose kan aan de originele formule worden toegevoegd. U hoeft Tween 80 niet te hebben, aangezien glucose de vorming van chlamydosporen remt.
Gebruik
Het gebruik van maïsmeelagar is voornamelijk bedoeld voor de studie van Candida-stammen, en helpt hun identificatie door de karakteristieke observatie van chlamydosporen in de albicans-soort. Dat wil zeggen, het gebruik van deze agar dient als een aanvullende methode om deze gisten te identificeren..
Zowel saprofytische als pathogene soorten kunnen zich op deze agar ontwikkelen, maar elk vormt karakteristieke myceliumstructuren. Soorten van het geslacht Torulopsis produceren bijvoorbeeld geen mycelium en planten zich alleen voort door blastoconidia..
Evenzo produceren de Trichosporon- en Geotrichum-soorten arthroconidia op maïsmeelagar en is het soms moeilijk om onderscheid te maken tussen de een en de ander..
Arthroconidia van het geslacht Geotrichum produceren een verlenging van de hyfen die lijkt op een hockeystick..
Ook de productie van pigmenten met maïsmeelagar aangevuld met glucose is nuttig bij de identificatie van Trichophytom rubrum.
Gezaaid
Verdachte Candida-kolonies die zijn verkregen in het primaire kweekmedium - Sabouraud-agar - uit klinische monsters, cosmetica, aarde, onder andere, worden gesubkweekt op maïsmeelagar. Het medium wordt gezaaid en 24 tot 48 uur bij 22 ° C geïncubeerd. De incubatietijd kan indien nodig worden verlengd.
Chlamydospore-demonstratie
Hiervoor moet de maïsmeel-agar met Tween 80 worden geïnoculeerd met de Dalmau-techniek. Deze methode bestaat uit het nemen van een deel van de verdachte kolonie met het platina handvat en drie parallelle sneden in het midden, waarbij het handvat op 45 ° wordt gehouden. De sneden moeten op een afstand van 1 cm van elkaar worden gescheiden.
Vervolgens wordt een eerder gevlamd afdekobject op de ingezaaide strepen geplaatst, zodat de helft bedekt is en de andere onbedekt.
Incubeer de geplaatste platen bij 30 ° C gedurende 48-72 uur en onderzoek vervolgens microscopisch door de dekglaasje..
Onderhoud van schimmelstammen
Voor het behoud van de stammen worden de gezaaide en gekweekte platen bewaard in een koelkast (4 tot 8 ºC). Op deze manier kunnen ze enkele weken meegaan en worden gebruikt voor onderwijs- of onderzoeksdoeleinden..
QA
Voor de steriliteitscontrole wordt een plaat zonder inoculatie bij kamertemperatuur geïncubeerd, er wordt verwacht dat er geen groei of kleurverandering zal zijn.
Voor kwaliteitscontrole, bekende soorten zoals: Staphylococcus aureus, ATCC 6538, Escherichia coli ATCC 25922, Aspergillus niger ATCC 16404, Candida albicans ATCC 1023, Saccharomyces cerevisiae ATCC 9763.
De verwachte resultaten zijn gedeeltelijke remming voor S. aureus Y E coli. Terwijl bij de rest van de soorten een bevredigende groei wordt verwacht.
Aspergillus niger groeit met zwarte en gesporuleerde kolonies in een tijd van ongeveer 5 dagen incubatie.
Candida albicans gistkolonies met productie van chlamydosporen.
Saccharomyces cerevisiae produceren grote gistcellen.
Beperkingen
Op de bodem van de plaat vormt zich een geel neerslag dat niet met kolonies mag worden verward..
Referenties
- Neogen Laboratories. Maïsmeel Agar. Beschikbaar op: foodsafety.neogen.com.
- Culture Media Microkit. Maïsmeel Agar. Beschikbaar op: Medioscultivo.com.
- Linares M, Solís F. Identificatiegids voor gist. Beschikbaar op: http: //www.guia.revibero.
- Urcia F, Guevara M. Rev. Perú Med.Exp. Public Health, 2002; 19 (4): 206-208. Beschikbaar op: Scielo.com
- Casas-Rincón G. Algemene mycologie. 1994. 2e editie Centrale Universiteit van Venezuela, bibliotheekuitgaven. Venezuela Caracas.
- Forbes B, Sahm D, Weissfeld A. (2009). Bailey & Scott Microbiologische diagnose. 12 ed. Redactioneel Panamericana S.A. Argentinië.
- Koneman E, Allen S, Janda W, Schreckenberger P, Winn W. (2004). Microbiologische diagnose. 5e druk. Redactioneel Panamericana S.A. Argentinië.
- Castillo E. Vergelijkende studie van enkele macro- en microscopische methoden voor de isolatie en herkenning van het geslacht Candida. Colombiaanse Rev. of Pharmaceutical Chemical Sciences. 1970; 3 (1): 33-57. Beschikbaar op: Ciencias.unal.edu.co



Niemand heeft nog op dit artikel gereageerd.