
Primaire alcoholstructuur, eigenschappen, nomenclatuur, voorbeelden
EEN primaire alcohol is er een waarin de hydroxylgroep is gehecht aan een primair koolstofatoom; dat wil zeggen een koolstof die covalent is gebonden aan een andere koolstof en waterstofatomen. De algemene formule is ROH, in het bijzonder RCHtweeOH, aangezien er maar één alkylgroep R is.
De R-groep met de formule RCHtweeOH kan elk zijn: een ketting, een ring of heteroatomen. Als het gaat om een ketting, kort of lang, hebben we te maken met de meest representatieve primaire alcoholen; onder hen zijn methanol en ethanol, twee van de meest gesynthetiseerde op industriële niveaus.

Fysiek zijn ze als andere alcoholen, en hun kook- of smeltpunt hangt af van de mate van hun vertakking; maar chemisch zijn ze het meest reactief. Bovendien is de zuurgraad hoger dan die van secundaire en tertiaire alcoholen.
Primaire alcoholen ondergaan oxidatiereacties en worden een groot aantal organische verbindingen: esters en ethers, aldehyden en carbonzuren. Evenzo kunnen ze uitdrogingsreacties ondergaan, waarbij ze in alkenen of alkenen veranderen.
Artikel index
- 1 Structuur van een primaire alcohol
- 2 Eigenschappen
- 2.1 Zuurgraad
- 2.2 Chemische reacties
- 3 Nomenclatuur
- 4 voorbeelden
- 5 referenties
Structuur van een primaire alcohol
De primaire alcoholen afgeleid van lineaire alkanen zijn het meest representatief. In werkelijkheid kan echter elke structuur, zowel lineair als vertakt, binnen dit type alcoholen worden ingedeeld, zolang de OH-groep is gekoppeld aan een CHtwee.
Structureel hebben ze dus allemaal de aanwezigheid van de groep -CH gemeentweeOH, methylol genaamd. Kenmerkend en gevolg van dit feit is dat de OH-groep minder gehinderd wordt; dat wil zeggen, het kan interageren met de omgeving zonder ruimtelijke interferentie van andere atomen.
Evenzo betekent een minder gehinderde OH dat het koolstofatoom dat het draagt, dat van de CHtwee, kunnen substitutiereacties ondergaan via een SN-mechanismetwee (bimoleculair, zonder de vorming van een carbokation).
Aan de andere kant wordt een OH met een grotere vrijheid om te interageren met het medium vertaald als sterkere intermoleculaire interacties (door waterstofbruggen), die op hun beurt het smelt- of kookpunt verhogen..
Hetzelfde gebeurt met zijn oplosbaarheid in polaire oplosmiddelen, zolang de R-groep niet erg hydrofoob is..
Eigendommen
Zuurgraad
De primaire alcoholen zijn van de meest zuurrijke. Om ervoor te zorgen dat een alcohol zich gedraagt als een Bronsted-zuur, moet u een H-ion doneren+ aan het medium, om te zeggen water, om een alkoxide-anion te worden:
ROH + HtweeOF <=> RO- + H.3OF+
De negatieve lading van RO-, specifiek van de RCHtweeOF-, wordt minder afgestoten door de elektronen in de twee CH-bindingen dan door de elektronen in de CR-binding.
De alkylgroep oefent dan de grootste afstoting uit en destabiliseert RCHtweeOF-maar niet zozeer vergeleken met dat als er twee of drie R-groepen waren, zoals bij respectievelijk secundaire en tertiaire alcoholen.
Een andere manier om de hogere zuurgraad van een primaire alcohol te verklaren, is door het elektronegativiteitsverschil, waardoor het dipoolmoment ontstaat: HtweeCδ+-OFδ-H. Zuurstof trekt elektronendichtheid van beide CHtwee vanaf H; de positieve gedeeltelijke lading van koolstof stoot die van waterstof een beetje af.
De R-groep draagt een deel van zijn elektronendichtheid over aan de CHtwee, wat helpt om zijn positieve gedeeltelijke lading te verminderen en daarmee zijn afstoting voor de waterstoflading. Hoe meer R-groepen er zijn, hoe lager de afstoting, en dus de neiging van H om als H vrijgelaten te worden+.
pKa
Primaire alcoholen worden als zwakkere zuren beschouwd dan water, met uitzondering van methylalcohol, dat iets sterker is. De pKa van methylalcohol is 15,2; en de pKa van ethylalcohol is 16,0. Ondertussen is de pKa van water 15,7.
Water, dat als een zwak zuur wordt beschouwd, zoals alcoholen, kan echter binden aan H.+ om te zetten in het hydroniumion, H3OF+dat wil zeggen, het gedraagt zich als een basis.
Op dezelfde manier kunnen primaire alcoholen waterstof opnemen; vooral bij enkele van zijn eigen reacties, bijvoorbeeld bij de omzetting in alkenen of olefinen.
Chemische reacties
Vorming van alkylhalogeniden
Alcoholen reageren met waterstofhalogeniden om alkylhalogeniden te produceren. De reactiviteit van alcoholen met waterstofhalogeniden neemt af in de volgende volgorde:
Tertiaire alcohol> secundaire alcohol> primaire alcohol
ROH + HX => RX + HtweeOF
RX is een primair alkylhalogenide (CH3Cl, CH3CHtweeBr, enz.).
Een andere manier om alkylhalogeniden te bereiden, is door thionylchloride, een synthetisch reagens, te laten reageren met een primaire alcohol die wordt omgezet in een alkylchloride. Thionylchloride (SOCltwee) vereist de aanwezigheid van pyridine om te reageren.
CH3(CHtwee3CHtweeOH + SOCltwee => CH3(CHtwee3CHtweeCl + SOtwee + HCl
Deze reactie komt overeen met de halogenering van 1-pentanol om 1-chloorpentaan te worden in aanwezigheid van pyridine.
Oxidatie van primaire alcoholen
Afhankelijk van het reagens kunnen alcoholen worden geoxideerd tot aldehyden en carbonzuren. Pyridiniumchloorchromaat (PCC) oxideert primaire alcohol tot aldehyde, met behulp van dichloormethaan (CHtweeCltwee
CH3(CHtwee5CHtweeOH => CH3(CHtwee5COH
Dit is de oxidatie van 1-heptanol tot 1-heptanal.
Ondertussen kaliumpermanganaat (KMnO4) oxideert eerst de alcohol tot aldehyde en oxideert vervolgens het aldehyde tot carbonzuur. Wanneer kaliumpermanganaat wordt gebruikt om alcoholen te oxideren, moet het verbreken van de binding tussen koolstofatomen 3 en 4 worden vermeden..
CH3(CHtwee4CHtweeOH => CH3(CHtwee4COOH
Dit is de oxidatie van 1-hexanol tot hexaanzuur.
Met deze methode is het moeilijk om een aldehyde te verkrijgen, aangezien het gemakkelijk wordt geoxideerd tot een carbonzuur. Een vergelijkbare situatie wordt waargenomen wanneer chroomzuur wordt gebruikt om alcoholen te oxideren.
Vorming van ethers
Primaire alcoholen kunnen worden omgezet in ethers bij verhitting in aanwezigheid van een katalysator, meestal zwavelzuur:
2 RCHtweeOH => RCHtweeOCHtweeR + HtweeOF
Vorming van organische esters
De condensatie van een alcohol en een carbonzuur, Fisher's verestering, gekatalyseerd door een zuur, produceert een ester en water:
R'OH + RCOOH <=> RCOOR '+ HtweeOF
Een bekende reactie is die van ethanol met azijnzuur, om ethylacetaat te geven:
CH3CHtweeOH + CH3COOH <=> CH3COOHCHtweeCH3 + H.tweeOF
Primaire alcohol is het meest vatbaar voor Fischer-veresteringsreacties.
Uitdroging
Bij hoge temperaturen en in een zuur milieu, meestal zwavelzuur, dehydrateren alcoholen om alkenen te vormen met verlies van een watermolecuul.
CH3CHtweeOH => HtweeC = CHtwee + H.tweeOF
Dit is de dehydratatiereactie van ethanol tot ethyleen. Een geschiktere algemene formule voor dit type reactie, specifiek voor een primaire alcohol, zou zijn:
RCHtweeOH => R = CHtwee (wat ook gelijk is aan RC = CHtwee
Nomenclatuur
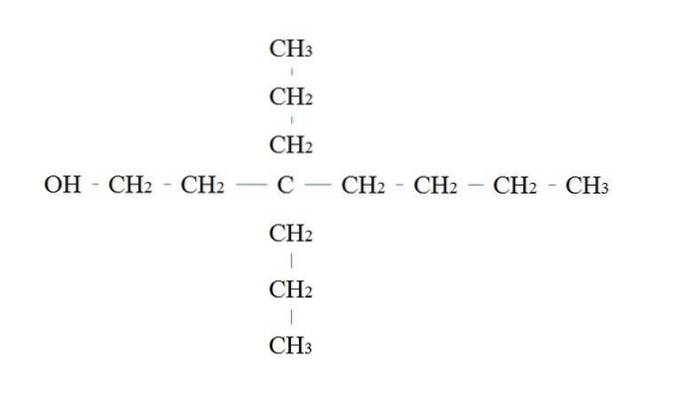
De regels voor het benoemen van een primaire alcohol zijn dezelfde als voor de andere alcoholen; met de uitzondering dat het soms niet nodig is om de OH-dragende koolstof te vermelden.
In de bovenste afbeelding is er een hoofdketen van zeven koolstofatomen. De koolstof die aan de OH is gebonden, krijgt het nummer 1 toegewezen en begint dan van links naar rechts te tellen. De IUPAC-naam is daarom: 3,3-diethylheptanol.
Merk op dat dit een voorbeeld is van een sterk vertakte primaire alcohol.
Voorbeelden
Ten slotte worden enkele primaire alcoholen genoemd op basis van hun traditionele en systematische nomenclatuur:
-Methyl, CH3Oh
-Ethyl, CH3CHtweeOh
-n-propyl, CH3CHtweeCHtweeOh
-n-hexyl, CH3CHtweeCHtweeCHtweeCHtweeCHtweeOh
Dit zijn derivaten van lineaire alkanen. Andere voorbeelden zijn:
-2-fenylethanol, C.6H.5CHtweeCHtweeOH (C6H.5 = benzeenring)
-2-propeen-1-ol (allylalcohol), CHtwee= CHCHtweeOh
-1,2-ethaandiol, CHtweeOHCHtweeOh
-2-chloorethanol (ethyleenchloorhydrine), ClCHtweeCHtweeOh
-2-buten-1-ol (crotylalcohol), CH3CH = CHCHtweeOh
Referenties
- Morrison, R.T. en Boyd, R. N. (1987). Organische chemie. (5ta Editie). Addison-Wesley Iberoamericana
- Carey, F. A. (2008). Organische chemie. (6ta Editie). McGraw-Hill, Interamerica, Editores S.A.
- Mel Science. (2019). Hoe de oxidatie van primaire alcoholen plaatsvindt. Hersteld van: melscience.com
- Royal Society of Chemistry. (2019). Definitie: primaire alcoholen. Hersteld van: rsc.org
- Chriss E. McDonald. (2000). De oxidatie van primaire alcoholen tot esters: drie gerelateerde onderzoeksexperimenten. J. Chem. Educ., 2000, 77 (6), p. 750. DOI: 10.1021 / ed077p750


Niemand heeft nog op dit artikel gereageerd.