
Alcoholen structuur, eigenschappen, nomenclatuur en gebruik
De alcoholen het zijn organische verbindingen die worden gekenmerkt doordat ze een hydroxylgroep (-OH) hebben die is gekoppeld aan een verzadigde koolstof; dat wil zeggen, een koolstofatoom dat is verbonden met vier atomen door enkele bindingen (zonder dubbele of drievoudige bindingen).
De generieke formule voor deze uitgebreide en veelzijdige familie van verbindingen is ROH. Om in strikt chemische zin als een alcohol te worden beschouwd, moet de OH-groep de meest reactieve zijn in de moleculaire structuur. Dit is belangrijk om onder verschillende moleculen met OH-groepen te kunnen bevestigen welke van hen een alcohol is..

Een van de typische alcoholen en de bekendste in de populaire cultuur is ethylalcohol of ethanol, CH3CHtweeOH. Afhankelijk van hun natuurlijke oorsprong, en dus hun chemische omgeving, kunnen hun mengsels een onbeperkt spectrum aan smaken voortbrengen; sommige, die zelfs positieve veranderingen in het gehemelte laten zien met de vlieg van de jaren.
Het zijn mengsels van organische en anorganische verbindingen met ethylalcohol, die aanleiding geeft tot consumptie ervan bij sociale en religieuze evenementen sinds tijden voor Christus; zoals met druivenwijn, of met glazen geserveerd voor een feest, naast stoten, snoepjes, panettones, enz..
Het met mate genieten van deze dranken is het resultaat van de synergie tussen ethylalcohol en zijn omhullende chemische matrix; zonder dit, als pure stof, wordt het buitengewoon gevaarlijk en veroorzaakt het een reeks negatieve gevolgen voor de gezondheid.
Het is om deze reden dat het verbruik van waterige mengsels van CH3CHtweeOH, zoals die gekocht in apotheken voor antiseptische doeleinden, vormt een groot risico voor het lichaam.
Andere alcoholen die ook erg populair zijn, zijn menthol en glycerol. Dit laatste, evenals erythrol, wordt in veel voedingsmiddelen als additief aangetroffen om ze tijdens opslag te zoeten en te bewaren. Er zijn overheidsinstanties die voorschrijven welke alcoholen kunnen worden gebruikt of geconsumeerd zonder neveneffecten..
Het dagelijkse gebruik van alcoholen achterlatend, zijn het chemisch gezien zeer veelzijdige stoffen, omdat vanaf hen andere organische verbindingen kunnen worden gesynthetiseerd; tot het punt dat sommige auteurs denken dat met een dozijn van hen alle noodzakelijke verbindingen kunnen worden gecreëerd om op een onbewoond eiland te leven.
Artikel index
- 1 Structuur van alcoholen
- 1.1 Amfifiel karakter
- 1.2 Structuur van R
- 2 Fysische en chemische eigenschappen
- 2.1 Kookpunt
- 2.2 Oplosmiddelcapaciteit
- 2.3 Amfoterie
- 3 Nomenclatuur
- 3.1 Algemene naam
- 3.2 IUPAC-systeem
- 4 Synthese
- 4.1 Hydratatie van alkenen
- 4.2 Oxo-proces
- 4.3 Fermentatie van koolhydraten
- 5 toepassingen
- 5.1 Drankjes
- 5.2 Chemische grondstof
- 5.3 Oplosmiddelen
- 5.4 Brandstoffen
- 5.5 Antiseptica
- 5.6 Andere toepassingen
- 6 referenties
Structuur van alcoholen
Alcoholen hebben een algemene formule van ROH. De OH-groep is gekoppeld aan de alkylgroep R, waarvan de structuur varieert van alcohol tot alcohol. De vereniging tussen R en OH is via een enkele covalente binding, R-OH.
De volgende afbeelding toont drie algemene structuren voor alcoholen, waarbij in gedachten moet worden gehouden dat het koolstofatoom verzadigd is; dat wil zeggen, het vormt vier eenvoudige koppelingen.
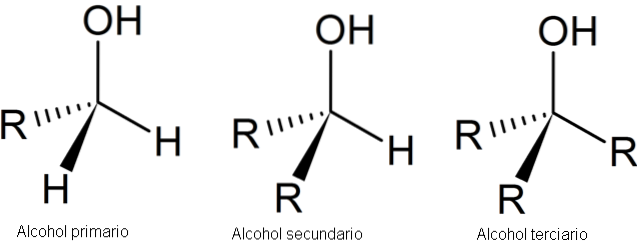
Zoals te zien is, kan R elk koolstofskelet zijn zolang het geen substituenten heeft die reactiever zijn dan de OH-groep..
In het geval van primaire alcohol, 1e, is de OH-groep gekoppeld aan een primair koolstofatoom. Dit is gemakkelijk te verifiëren door te observeren dat het atoom in het midden van de linker tetraëder is gebonden aan een R en twee H.
De secundaire alcohol, 2º, wordt geverifieerd met de koolstof van de tetraëder in het midden, nu gekoppeld aan twee R-groepen en één H.
En tot slot is er de tertiaire alcohol, 3º, met de koolstof gekoppeld aan drie R-groepen.
Amfifiel karakter
Afhankelijk van het type koolstof dat aan de OH is gekoppeld, is er de classificatie van primaire, secundaire en tertiaire alcoholen. In de tetraëders zijn de structurele verschillen tussen hen al gedetailleerd. Maar alle alcoholen, ongeacht hun structuur, hebben iets gemeen: het amfifiele karakter..
U hoeft geen structuur aan te pakken om het op te merken, alleen de chemische formule van ROH. De alkylgroep bestaat bijna volledig uit koolstofatomen en vormt een hydrofobe ruggengraat; dat wil zeggen, het reageert zeer zwak met water.
Aan de andere kant kan de OH-groep waterstofbruggen vormen met watermoleculen en dus hydrofiel zijn; dat wil zeggen, houdt van of heeft affiniteit met water. Alcoholen hebben dus een hydrofobe ruggengraat, gehecht aan een hydrofiele groep. Ze zijn tegelijkertijd apolair en polair, wat hetzelfde is als zeggen dat ze amfifiele stoffen zijn.
R-OH
(Hydrofoob) - (Hydrofiel)
Zoals in de volgende sectie zal worden uitgelegd, bepaalt het amfifiele karakter van alcoholen enkele van hun chemische eigenschappen..
Structuur van R
De alkylgroep R kan elke structuur hebben, en toch is het belangrijk omdat hierdoor alcoholen kunnen worden gecatalogiseerd.
R kan bijvoorbeeld een open keten zijn, zoals het geval is met ethanol of propanol; vertakt, zoals t-butylalcohol, (CH3tweeCHCHtweeOH; het kan cyclisch zijn, zoals in het geval van cyclohexanol; of het kan een aromatische ring hebben, zoals in benzylalcohol, (C.6H.5) CHtweeOH, of in 3-fenylpropanol, (C.6H.5) CHtweeCHtweeCHtweeOh.
De R-keten kan zelfs substituenten hebben zoals halogenen of dubbele bindingen, zoals voor de alcoholen 2-chloorethanol en 2-buteen-1-ol (CH3CHtwee= CHCHtweeOH).
Gezien dan de structuur van R, wordt de classificatie van alcoholen complex. Om deze reden is de classificatie op basis van hun structuur (1e, 2e en 3e alcoholen) eenvoudiger maar minder specifiek, hoewel het voldoende is om de reactiviteit van alcoholen te verklaren..
Fysische en chemische eigenschappen
Kookpunt
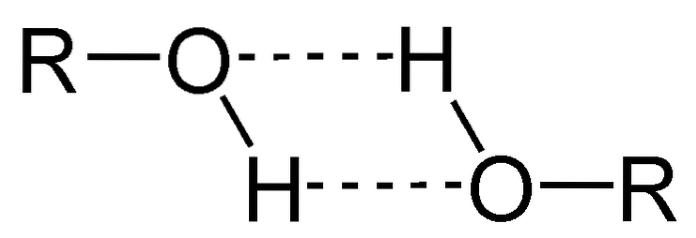
Een van de belangrijkste eigenschappen van alcoholen is dat ze zich associëren via waterstofbruggen.
In de afbeelding hierboven kun je zien hoe twee ROH-moleculen waterstofbruggen met elkaar vormen. Hierdoor zijn alcoholen meestal vloeistoffen met een hoog kookpunt..
Ethylalcohol heeft bijvoorbeeld een kookpunt van 78,5 ° C. Deze waarde neemt toe naarmate de alcohol zwaarder wordt; dat wil zeggen, de R-groep heeft een grotere massa of een groter aantal atomen. Dus n-butylalcohol, CH3CHtweeCHtweeCHtweeOH, heeft een kookpunt van 97ºC, iets lager dan dat van water.
Glycerol is een van de alcoholen met het hoogste kookpunt: 290ºC.
Waarom? Omdat niet alleen de massa of structuur van R beïnvloedt, maar ook het aantal OH-groepen. Glycerol heeft drie OH's in zijn structuur: (HO) CHtweeCH (OH) CHtwee(OH). Dit maakt het in staat om veel waterstofbruggen te vormen en zijn moleculen steviger bij elkaar te houden..
Aan de andere kant, sommige alcoholen zijn vast op kamertemperatuur; als dezelfde glycerol bij een temperatuur lager dan 18ºC. Daarom is de bewering dat alle alcoholen vloeibare stoffen zijn, onjuist..
Oplosmiddel capaciteit
In huizen is het heel gebruikelijk om isopropylalcohol te gebruiken om een vlek te verwijderen die moeilijk te verwijderen is op een oppervlak. Deze capaciteit van het oplosmiddel, die zeer nuttig is voor chemische synthese, is te danken aan het amfifiele karakter ervan, dat eerder werd uitgelegd.
Vetten kenmerken zich doordat ze hydrofoob zijn: daarom zijn ze moeilijk met water te verwijderen. In tegenstelling tot water hebben alcoholen echter een hydrofoob aandeel in hun structuur.
De alkylgroep R heeft dus een wisselwerking met vetten, terwijl de OH-groep waterstofbruggen vormt met water, waardoor ze worden verplaatst..
Amfoterie
Alcoholen kunnen reageren als zuren en basen; dat wil zeggen, het zijn amfotere stoffen. Dit wordt weergegeven door de volgende twee chemische vergelijkingen:
ROH + H+ => ROHtwee+
ROH + OH- => RO-
RO- is de algemene formule van wat bekend staat als een alkoxide.
Nomenclatuur
Er zijn twee manieren om alcoholen te benoemen, waarvan de complexiteit afhangt van hun structuur.
Gemeenschappelijke naam
Alcoholen kunnen bij hun gewone naam worden genoemd. Welke zijn? Hiervoor moet de naam van de R-groep bekend zijn, waaraan de uitgang -ico wordt toegevoegd, en wordt voorafgegaan door het woord 'alcohol'. Bijvoorbeeld de CH3CHtweeCHtweeOH is propylalcohol.
Andere voorbeelden zijn:
-CH3OH: methylalcohol
-(CH3tweeCHCHtweeOH: isobutylalcohol
-(CH33COH: tert-butylalcohol
IUPAC-systeem
Wat gangbare namen betreft, moet u beginnen met het identificeren van R. Het voordeel van dit systeem is dat het veel nauwkeuriger is dan het andere..
R, dat een koolstofskelet is, kan vertakkingen of meerdere ketens hebben; de langste keten, dat wil zeggen met meer koolstofatomen, zal de naam alcohol krijgen.
Aan de naam van het alkaan van de langste keten wordt het einde 'l' toegevoegd. Daarom bij CH3CHtweeOH heet ethanol (CH3CHtwee- + OH).
Over het algemeen moet de OH de laagst mogelijke opsomming hebben. Bijvoorbeeld de BrCHtweeCHtweeCHtwee(OH) CH3 heet 4-broom-2-butanol, en niet 1-broom-3-butanol.
Synthese
Alkeen hydratatie
Het oliekraakproces produceert een mengsel van alkenen met vier of vijf koolstofatomen, die gemakkelijk kunnen worden gescheiden.
Deze alkenen kunnen worden omgezet in alcoholen door directe toevoeging van water of door reactie van het alkeen met zwavelzuur, gevolgd door de toevoeging van het water dat het zuur splitst, afkomstig van de alcohol..
Oxo-proces
In aanwezigheid van een geschikte katalysator reageren alkenen met koolmonoxide en waterstof om aldehyden te vormen. Aldehyden kunnen gemakkelijk worden gereduceerd tot alcoholen door een katalytische hydrogeneringsreactie.
Vaak is er een zodanige synchronisatie van het oxo-proces dat de reductie van de aldehyden bijna gelijktijdig gaat met hun vorming..
De meest gebruikte katalysator is dicobaltoctocarbonyl, verkregen door de reactie tussen kobalt en koolmonoxide.
Fermentatie van koolhydraten
De fermentatie van koolhydraten door gist is nog steeds van groot belang bij de productie van ethanol en andere alcoholen. Suikers zijn afkomstig van suikerriet of zetmeel dat is verkregen uit verschillende granen. Om deze reden wordt ethanol ook wel "graanalcohol" genoemd.
Toepassingen
Drankjes
Hoewel het niet de belangrijkste functie van alcoholen is, is de aanwezigheid van ethanol in sommige dranken een van de meest populaire kennis. Zo is ethanol, een product van de fermentatie van suikerriet, druiven, appels, enz. Aanwezig in tal van dranken voor sociale consumptie..
Chemische grondstof
-Methanol wordt gebruikt bij de productie van formaldehyde door zijn katalytische oxidatie. Formaldehyde wordt gebruikt bij de vervaardiging van kunststoffen, verf, textiel, explosieven, enz..
-Butanol wordt gebruikt bij de productie van butaanethanoaat, een ester die wordt gebruikt als smaakstof in de voedingsmiddelen- en zoetwarenindustrie..
-Allylalcohol wordt gebruikt bij de productie van esters, waaronder diallylftalaat en diallylisoftalaat, die als monomeren dienen.
-Fenol wordt gebruikt bij de productie van harsen, de fabricage van nylon, deodorants, cosmetica, enz..
-Alcoholen met een rechte keten van 11-16 koolstofatomen worden gebruikt als tussenproducten om weekmakers te verkrijgen; bijvoorbeeld polyvinylchloride.
-De zogenaamde vetalcoholen worden gebruikt als tussenproducten bij de synthese van wasmiddelen.
Oplosmiddelen
-Methanol wordt gebruikt als verfverdunner, evenals 1-butanol en isobutylalcohol.
-Ethylalcohol wordt gebruikt als oplosmiddelen voor veel verbindingen die onoplosbaar zijn in water, en worden gebruikt als oplosmiddel in verf, cosmetica, enz..
-Vetalcoholen worden gebruikt als oplosmiddelen in de textielindustrie, in kleurstoffen, in wasmiddelen en in verven. Isobutanol wordt gebruikt als oplosmiddel in coatingmaterialen, verven en lijmen.
Brandstoffen
-Methanol wordt gebruikt als brandstof in verbrandingsmotoren en als benzineadditief om de verbranding te verbeteren.
-Ethylalcohol wordt gebruikt in combinatie met fossiele brandstoffen in motorvoertuigen. Voor dit doel zijn uitgestrekte regio's van Brazilië bestemd voor de teelt van suikerriet voor de productie van ethylalcohol. Deze alcohol heeft het voordeel dat bij zijn verbranding alleen kooldioxide wordt geproduceerd..
Wanneer ethylalcohol wordt verbrand, produceert het een schone, rookloze vlam, en daarom wordt het gebruikt als brandstof in veldkeukens..
-Gegeleerde alcohol wordt geproduceerd door methanol of ethanol te combineren met calciumacetaat. Deze alcohol wordt gebruikt als warmtebron in veldkachels, en omdat het morst, is het veiliger dan vloeibare alcoholen.
-De zogenaamde biobutanol wordt gebruikt als brandstof bij transport, evenals isopropylalcohol die als brandstof kan worden gebruikt; hoewel het gebruik ervan niet wordt aanbevolen.
Antiseptica
Isopropylalcohol met een concentratie van 70% wordt gebruikt als extern antisepticum om ziektekiemen te elimineren en hun groei te vertragen. Evenzo wordt voor dit doel ethylalcohol gebruikt..
Andere gebruiken
Cyclohexanol en methylcyclohexanol worden gebruikt bij textielveredeling, meubelverwerking en vlekverwijderaars.
Referenties
- Graham Solomons T.W., Craig B. Fryhle. (2011). Organische chemie. Amines. (10th editie.). Wiley plus.
- Carey F. (2008). Organische chemie. (Zesde editie). Mc Graw Hill.
- Morrison en Boyd. (1987). Organische chemie. (Vijfde editie). Addison-Wesley Iberoamericana.
- Dr. JA Colapret. (s.f.). Alcoholen. Hersteld van: colapret.cm.utexas.edu
- Het onderwijspartnerschap voor alcoholfarmacologie. (s.f.). Wat is alcohol? Duke universiteit. Hersteld van: sites.duke.edu
- Whittemore F. (s.f.). Soorten en toepassingen van alcohol. Hersteld van: livestrong.com
- Wikipedia. (2018). Alcohol. Hersteld van: en.wikipedia.org



Niemand heeft nog op dit artikel gereageerd.